Fe Hoá Trị Mấy? Khi Nào Fe Có Hoá Trị II và Hoá Trị III?
Bạn đang thắc mắc về Hoá Trị Của Sắt (Fe)? CAUHOI2025.EDU.VN sẽ giúp bạn hiểu rõ về hoá trị của sắt (Fe), một nguyên tố quan trọng trong hóa học, cũng như các yếu tố ảnh hưởng đến sự thay đổi hoá trị này. Bài viết này cung cấp thông tin chi tiết về hoá trị của sắt, giúp bạn nắm vững kiến thức và áp dụng vào thực tế. Tìm hiểu ngay để hiểu rõ hơn về sắt và các hợp chất của nó!
1. Hoá Trị Của Sắt (Fe) Trong Hóa Học Là Bao Nhiêu?
Sắt (Fe) có hai hoá trị phổ biến là +2 và +3, tùy thuộc vào các phản ứng hóa học và điều kiện cụ thể. Sự thay đổi hóa trị này làm cho sắt trở thành một nguyên tố linh hoạt và quan trọng trong nhiều ứng dụng khác nhau.

1.1. Tại Sao Sắt Có Hai Hoá Trị?
Để hiểu rõ tại sao sắt có thể thể hiện hai hoá trị khác nhau, chúng ta cần xem xét cấu hình electron của nó. Theo Giáo trình Hóa học Vô cơ của Đại học Quốc gia Hà Nội, cấu hình electron quyết định khả năng tham gia phản ứng và hình thành liên kết của một nguyên tố.
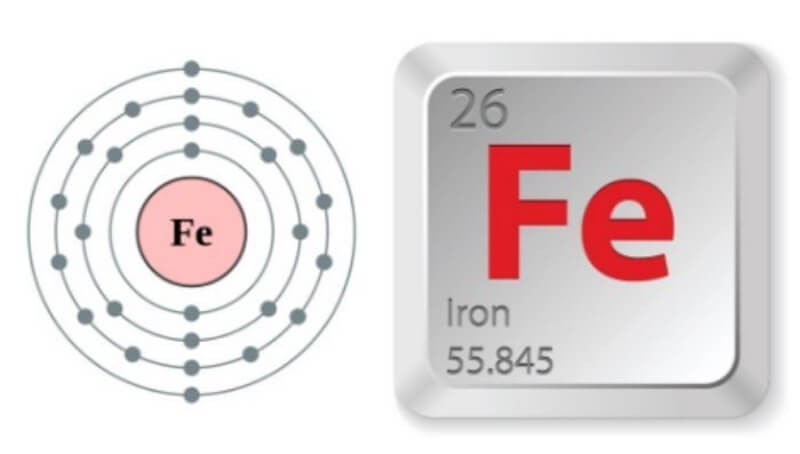
- Số hiệu nguyên tử của Fe là 26.
- Cấu hình electron đầy đủ: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s².
- Viết gọn: [Ar] 3d⁶ 4s².
Sắt thuộc chu kỳ 4, nhóm VIIIB trong bảng tuần hoàn các nguyên tố hóa học.
Hoá trị của một nguyên tố là số lượng electron mà nguyên tố đó có thể mất, nhận hoặc chia sẻ để đạt được cấu hình electron bền vững, tương tự như khí hiếm. Trong trường hợp của sắt, quỹ đạo 3d có các electron chưa ghép cặp, điều này cho phép sắt thể hiện hai trạng thái hoá trị +2 và +3.
- Khi sắt mất đi 2 electron ở lớp 4s, nó trở thành ion Fe²⁺, mang hoá trị +2.
- Sắt cũng có thể mất thêm một electron ở lớp 3d đã ghép cặp, tạo thành ion Fe³⁺, mang hoá trị +3. Khi đó, toàn bộ quỹ đạo 3d chứa đầy các electron chưa ghép cặp, tạo nên cấu hình bền vững hơn.
1.2. Ví Dụ Về Sắt Theo Hoá Trị
- Hoá trị +2: FeO (oxit sắt(II)), FeSO₄ (sunfat sắt(II)), Fe(OH)₂ (hiđroxit sắt(II)).
- Hoá trị +3: Fe₂O₃ (oxit sắt(III)), Fe₂(SO₄)₃ (sunfat sắt(III)), Fe(OH)₃ (hiđroxit sắt(III)).
Như vậy, sắt có khả năng linh hoạt thay đổi hoá trị giữa +2 và +3 tùy thuộc vào điều kiện phản ứng. Điều này cho phép nó tham gia vào nhiều hợp chất quan trọng trong hóa học và công nghiệp.
2. Khi Nào Sắt (Fe) Có Hoá Trị II và Khi Nào Có Hoá Trị III?
Để hiểu rõ hơn về hoá trị của sắt trong các phản ứng hóa học, hãy cùng phân tích chi tiết các điều kiện và yếu tố ảnh hưởng đến sự thay đổi này.

2.1. Khi Nào Sắt (Fe) Có Hoá Trị II?
Sắt thể hiện hoá trị II trong các trường hợp sau:
- Tác dụng với axit trung bình, tức là những axit mà gốc axit không có tính oxi hóa mạnh như HCl, H₂SO₄ loãng,…
- Phản ứng với dung dịch muối của kim loại yếu hơn, chẳng hạn như muối đồng, muối chì hoặc muối sắt (III).
- Khi tác dụng với phi kim có hoạt động trung bình yếu cũng tạo ra muối Fe(II).
Ví dụ cụ thể:
- Tác dụng với axit trung bình:
- Fe + H₂SO₄ (loãng) → FeSO₄ + H₂
- Fe + 2HCl → FeCl₂ + H₂
- Tác dụng với dung dịch muối của kim loại yếu hơn:
- Fe + Cu(NO₃)₂ → Fe(NO₃)₂ + Cu
- Fe + 2FeCl₃ → 3FeCl₂
- Tác dụng với phi kim hoạt động trung bình yếu:
- Fe + S → FeS
2.2. Khi Nào Sắt (Fe) Có Hoá Trị III?
Sắt thể hiện hoá trị III khi:
- Phản ứng với axit có tính oxi hóa mạnh như HNO₃, H₂SO₄ đặc, nóng. Theo một nghiên cứu của Khoa Hóa học, Đại học Khoa học Tự nhiên TP.HCM, axit nitric đặc có khả năng oxi hóa mạnh mẽ kim loại, đẩy chúng lên trạng thái oxi hóa cao nhất.
- Tác dụng với phi kim mạnh như F₂, Cl₂.
- Hợp chất sắt (II) bị oxi hóa bởi chất oxi hóa mạnh, chuyển thành hợp chất sắt (III).
Ví dụ cụ thể:
- Tác dụng với axit có tính oxi hóa mạnh:
- 2Fe + 6H₂SO₄ (đặc, nóng) → Fe₂(SO₄)₃ + 6H₂O + 3SO₂
- Tác dụng với phi kim mạnh:
- 2Fe + 3Cl₂ → 2FeCl₃
- Hợp chất sắt (II) bị oxi hóa thành sắt (III):
- 2FeCl₂ + Cl₂ → 2FeCl₃
- 4FeO + O₂ → 2Fe₂O₃
3. Các Yếu Tố Ảnh Hưởng Đến Hoá Trị Của Sắt
Ngoài các điều kiện phản ứng cụ thể, một số yếu tố khác cũng có thể ảnh hưởng đến hoá trị của sắt, bao gồm:
- Độ âm điện của các nguyên tố khác trong hợp chất: Nếu sắt liên kết với các nguyên tố có độ âm điện cao (ví dụ: oxi, clo), nó có xu hướng thể hiện hoá trị dương cao hơn.
- Môi trường phản ứng: Môi trường axit hoặc bazơ có thể ảnh hưởng đến sự ổn định của các ion sắt khác nhau.
- Sự có mặt của chất xúc tác: Một số chất xúc tác có thể thúc đẩy quá trình oxi hóa hoặc khử, làm thay đổi hoá trị của sắt.
Hiểu rõ các yếu tố này giúp chúng ta dự đoán và kiểm soát hoá trị của sắt trong các phản ứng hóa học khác nhau.
4. Ứng Dụng Của Sắt Dựa Trên Sự Thay Đổi Hoá Trị
Sự linh hoạt trong hoá trị của sắt đã mở ra nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
- Trong công nghiệp: Sắt là thành phần chính của thép, một vật liệu xây dựng quan trọng. Khả năng thay đổi hoá trị của sắt cho phép điều chỉnh các tính chất của thép, tạo ra các loại thép khác nhau phù hợp với các ứng dụng khác nhau.
- Trong y học: Các hợp chất sắt được sử dụng để điều trị thiếu máu do thiếu sắt. Sắt ở dạng ion Fe²⁺ dễ dàng hấp thụ vào cơ thể hơn so với Fe³⁺.
- Trong môi trường: Sắt được sử dụng để xử lý nước thải, loại bỏ các chất ô nhiễm như asen và crom.
5. Câu Hỏi Thường Gặp Về Hoá Trị Của Sắt (FAQ)
Dưới đây là một số câu hỏi thường gặp về hoá trị của sắt:
- Sắt có hoá trị 0 không? Có, sắt có hoá trị 0 trong trạng thái nguyên tử tự do.
- Hợp chất nào của sắt có hoá trị cao nhất? Hợp chất có hoá trị cao nhất của sắt là ferrat (VI) (ví dụ: K₂FeO₄), trong đó sắt có hoá trị +6.
- Làm thế nào để phân biệt sắt (II) và sắt (III)? Có thể sử dụng các thuốc thử đặc biệt để phân biệt hai loại ion này. Ví dụ, dung dịch thuốc tím (KMnO₄) sẽ bị mất màu khi tác dụng với sắt (II) nhưng không phản ứng với sắt (III).
- Sắt (II) có dễ bị oxi hóa thành sắt (III) không? Có, sắt (II) dễ bị oxi hóa thành sắt (III) trong môi trường có oxi hoặc chất oxi hóa.
- Tại sao sắt (III) lại bền hơn sắt (II) trong môi trường axit? Ion Fe³⁺ có kích thước nhỏ hơn và điện tích lớn hơn, tạo ra lực hút mạnh hơn với các phân tử nước, làm cho nó ổn định hơn trong môi trường axit.
- Sắt có thể tạo thành hợp chất phức không? Có, sắt có khả năng tạo thành nhiều hợp chất phức với các phối tử khác nhau.
- Ứng dụng của phức chất sắt trong thực tế là gì? Phức chất sắt được sử dụng trong nhiều lĩnh vực, bao gồm xúc tác, y học và phân tích hóa học.
- Sắt có vai trò gì trong cơ thể sống? Sắt là thành phần quan trọng của hemoglobin, protein vận chuyển oxi trong máu.
- Thiếu sắt có gây ra bệnh gì không? Thiếu sắt có thể gây ra thiếu máu, mệt mỏi và các vấn đề sức khỏe khác.
- Làm thế nào để bổ sung sắt cho cơ thể? Có thể bổ sung sắt thông qua chế độ ăn uống giàu sắt hoặc sử dụng các sản phẩm bổ sung sắt.
Bạn vẫn còn những thắc mắc khác về hoá trị của sắt? Đừng ngần ngại truy cập CAUHOI2025.EDU.VN để tìm kiếm câu trả lời chi tiết và đáng tin cậy.
6. Tìm Hiểu Thêm Về Hoá Học Tại CAUHOI2025.EDU.VN
CAUHOI2025.EDU.VN là nơi bạn có thể tìm thấy câu trả lời cho mọi thắc mắc về hóa học và nhiều lĩnh vực khác. Chúng tôi cung cấp thông tin chi tiết, dễ hiểu và được kiểm chứng từ các nguồn uy tín. Nếu bạn đang gặp khó khăn trong việc học tập hoặc cần tư vấn về các vấn đề liên quan đến hóa học, đừng ngần ngại liên hệ với chúng tôi.
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CAUHOI2025.EDU.VN
Chúng tôi luôn sẵn lòng hỗ trợ bạn! Hãy truy cập CauHoi2025.EDU.VN ngay hôm nay để khám phá kho tàng kiến thức phong phú và tìm thấy câu trả lời bạn đang tìm kiếm.

