**H2O2 + MnO2 Hiện Tượng Gì? Giải Thích Chi Tiết A-Z**
Tìm hiểu phản ứng H2O2 và MnO2: hiện tượng, điều kiện, ứng dụng. CAUHOI2025.EDU.VN cung cấp thông tin chi tiết, dễ hiểu, giúp bạn nắm vững kiến thức hóa học quan trọng này và các phản ứng hóa học liên quan.
1. Phản Ứng Hóa Học Giữa H2O2 và MnO2
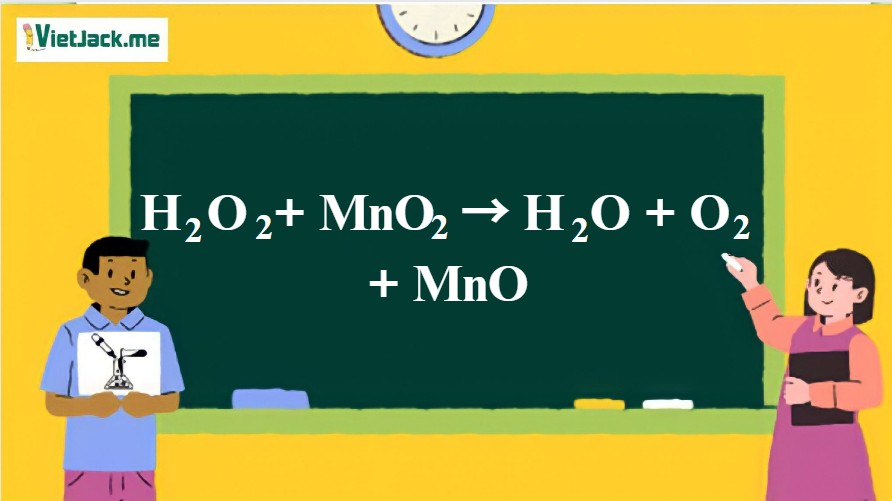
Phản ứng giữa hydro peroxide (H2O2) và mangan dioxide (MnO2) là một ví dụ điển hình về phản ứng phân hủy xúc tác. Phương trình hóa học tổng quát của phản ứng này là:
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Trong đó, MnO2 đóng vai trò là chất xúc tác, giúp tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình này.
2. Hiện Tượng Quan Sát Được Khi Cho H2O2 Tác Dụng Với MnO2
Khi cho MnO2 vào dung dịch H2O2, ta sẽ quan sát được những hiện tượng sau:
- Sủi bọt khí mạnh: Khí oxy (O2) được giải phóng nhanh chóng, tạo ra hiện tượng sủi bọt mạnh mẽ trong dung dịch.
- Nhiệt độ tăng nhẹ: Phản ứng phân hủy H2O2 là một phản ứng tỏa nhiệt, do đó nhiệt độ của dung dịch có thể tăng lên một chút. Tuy nhiên, sự thay đổi nhiệt độ thường không đáng kể.
- MnO2 không tan: Mangan dioxide (MnO2) là một chất rắn không tan trong nước. Vì vậy, nó vẫn tồn tại ở dạng chất rắn trong suốt quá trình phản ứng.

Alt: Hiện tượng sủi bọt khí mạnh khi cho MnO2 vào dung dịch H2O2
3. Giải Thích Chi Tiết Về Phản Ứng
3.1. Vai Trò Của MnO2
MnO2 đóng vai trò là chất xúc tác trong phản ứng này. Chất xúc tác là chất làm tăng tốc độ phản ứng hóa học mà không bị biến đổi về chất lượng và số lượng sau phản ứng. Cơ chế xúc tác của MnO2 có thể được giải thích như sau:
- Hấp phụ H2O2: MnO2 hấp phụ các phân tử H2O2 lên bề mặt của nó.
- Phân hủy H2O2: Trên bề mặt MnO2, các phân tử H2O2 bị phân hủy thành nước (H2O) và oxy (O2).
- Giải phóng sản phẩm: Các phân tử H2O và O2 được giải phóng khỏi bề mặt MnO2, và MnO2 lại sẵn sàng cho chu kỳ xúc tác tiếp theo.
3.2. Bản Chất Của H2O2
Hydro peroxide (H2O2) là một hợp chất hóa học có tính oxy hóa mạnh. Nó có thể tự phân hủy thành nước và oxy, nhưng tốc độ phân hủy rất chậm ở điều kiện thường. Sự có mặt của chất xúc tác như MnO2 làm tăng đáng kể tốc độ phân hủy này.
3.3. Ứng Dụng Thực Tế
Phản ứng giữa H2O2 và MnO2 có nhiều ứng dụng thực tế, bao gồm:
- Sản xuất oxy trong phòng thí nghiệm: Phản ứng này là một phương pháp đơn giản và hiệu quả để điều chế oxy trong phòng thí nghiệm.
- Tẩy trắng: H2O2 được sử dụng làm chất tẩy trắng trong nhiều ứng dụng, và MnO2 có thể được sử dụng để tăng cường hiệu quả tẩy trắng.
- Khử trùng: H2O2 có tính khử trùng, và phản ứng với MnO2 có thể tạo ra oxy nguyên tử, một chất khử trùng mạnh mẽ hơn.
4. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng
Tốc độ của phản ứng giữa H2O2 và MnO2 phụ thuộc vào nhiều yếu tố, bao gồm:
- Nồng độ H2O2: Nồng độ H2O2 càng cao, tốc độ phản ứng càng nhanh.
- Lượng MnO2: Lượng MnO2 càng nhiều, tốc độ phản ứng càng nhanh (trong một giới hạn nhất định).
- Nhiệt độ: Nhiệt độ càng cao, tốc độ phản ứng càng nhanh. Tuy nhiên, ở nhiệt độ quá cao, H2O2 có thể tự phân hủy mà không cần xúc tác.
- Diện tích bề mặt của MnO2: MnO2 ở dạng bột mịn có diện tích bề mặt lớn hơn, do đó xúc tác hiệu quả hơn so với MnO2 ở dạng cục lớn.
5. So Sánh Với Các Chất Xúc Tác Khác
Ngoài MnO2, còn có nhiều chất khác có thể xúc tác cho phản ứng phân hủy H2O2, chẳng hạn như:
- Kim loại chuyển tiếp: Các kim loại chuyển tiếp như sắt (Fe), đồng (Cu), và bạch kim (Pt) cũng có thể xúc tác cho phản ứng này.
- Enzyme catalase: Catalase là một enzyme có trong nhiều sinh vật sống, có khả năng xúc tác cho phản ứng phân hủy H2O2 với tốc độ rất cao.
So với các chất xúc tác khác, MnO2 có ưu điểm là rẻ tiền, dễ kiếm và dễ sử dụng. Tuy nhiên, hiệu quả xúc tác của nó thường không cao bằng các kim loại chuyển tiếp hoặc enzyme catalase.
6. Tính Chất Hóa Học Của H2O2 và MnO2
Để hiểu rõ hơn về phản ứng, chúng ta cần nắm vững tính chất hóa học của các chất tham gia:
6.1. Tính Chất Hóa Học Của Hydro Peroxide (H2O2)
- Tính Oxy Hóa và Tính Khử: H2O2 vừa có tính oxy hóa, vừa có tính khử, tùy thuộc vào chất phản ứng cùng.
- Phân Hủy: Dễ bị phân hủy thành nước và oxy. Phản ứng này được xúc tác bởi ánh sáng, nhiệt, kim loại nặng và các chất xúc tác khác.
- Tính Axit Yếu: H2O2 là một axit yếu, có thể tạo muối với một số bazơ.
6.2. Tính Chất Hóa Học Của Mangan Dioxide (MnO2)
- Tính Oxy Hóa Mạnh: MnO2 là một chất oxy hóa mạnh, đặc biệt trong môi trường axit.
- Không Tan Trong Nước: MnO2 là chất rắn không tan trong nước.
- Tính Xúc Tác: MnO2 là một chất xúc tác tốt cho nhiều phản ứng hóa học.
7. Ứng Dụng Quan Trọng Của H2O2 Trong Đời Sống và Công Nghiệp
Hydro peroxide (H2O2) là một hợp chất hóa học đa năng với nhiều ứng dụng quan trọng:
- Y tế:
- Khử trùng vết thương: Dung dịch H2O2 loãng (3%) thường được sử dụng để rửa và khử trùng vết thương nhỏ, vì nó có khả năng diệt khuẩn và làm sạch.
- Súc miệng: H2O2 pha loãng có thể dùng làm nước súc miệng để loại bỏ vi khuẩn và làm sạch khoang miệng.
- Công nghiệp:
- Tẩy trắng: H2O2 được sử dụng rộng rãi trong công nghiệp dệt may và giấy để tẩy trắng vải, sợi và bột giấy.
- Sản xuất hóa chất: H2O2 là nguyên liệu quan trọng trong sản xuất nhiều hóa chất khác, bao gồm các chất tẩy rửa, chất khử trùng và chất oxy hóa.
- Môi trường:
- Xử lý nước thải: H2O2 được sử dụng để oxy hóa các chất ô nhiễm trong nước thải, giúp làm sạch nước.
- Khử mùi: H2O2 có khả năng khử mùi hôi trong không khí và trên các bề mặt.
- Gia dụng:
- Tẩy rửa: H2O2 có thể được sử dụng để tẩy rửa các vết bẩn cứng đầu trên quần áo, sàn nhà và các bề mặt khác.
- Làm sáng răng: Một số sản phẩm làm trắng răng có chứa H2O2 với nồng độ thấp.
8. An Toàn Khi Sử Dụng H2O2 và MnO2
Khi làm việc với H2O2 và MnO2, cần tuân thủ các biện pháp an toàn sau:
- H2O2:
- Tránh tiếp xúc với da và mắt: H2O2 có thể gây kích ứng da và mắt. Nếu tiếp xúc, rửa ngay bằng nhiều nước sạch.
- Không được uống: H2O2 có thể gây bỏng đường tiêu hóa nếu uống phải.
- Bảo quản đúng cách: H2O2 nên được bảo quản trong容器 kín, ở nơi thoáng mát và tránh ánh sáng trực tiếp.
- MnO2:
- Tránh hít phải bụi MnO2: Bụi MnO2 có thể gây kích ứng đường hô hấp.
- Sử dụng trong môi trường thông thoáng: Nên sử dụng MnO2 trong môi trường thông thoáng để tránh tích tụ bụi.
9. Bài Tập Vận Dụng Liên Quan Đến Phản Ứng H2O2 và MnO2
Câu 1: Cho 10 ml dung dịch H2O2 3% tác dụng với một lượng nhỏ bột MnO2. Tính thể tích khí O2 thu được ở điều kiện tiêu chuẩn.
Hướng dẫn giải:
- Tính số mol H2O2 trong 10 ml dung dịch 3%.
- Theo phương trình phản ứng, 2 mol H2O2 tạo ra 1 mol O2.
- Tính số mol O2 tạo thành.
- Tính thể tích O2 ở điều kiện tiêu chuẩn (1 mol khí chiếm 22,4 lít).
Câu 2: Vì sao MnO2 được sử dụng làm chất xúc tác trong phản ứng phân hủy H2O2?
Hướng dẫn giải:
Giải thích vai trò của MnO2 trong việc giảm năng lượng hoạt hóa của phản ứng, từ đó làm tăng tốc độ phản ứng.
Câu 3: Nêu các yếu tố ảnh hưởng đến tốc độ phản ứng phân hủy H2O2 xúc tác bởi MnO2.
Hướng dẫn giải:
Liệt kê và giải thích ảnh hưởng của các yếu tố như nồng độ H2O2, lượng MnO2, nhiệt độ, và diện tích bề mặt của MnO2.
10. Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng H2O2 + MnO2
1. H2O2 có độc không?
H2O2 ở nồng độ thấp (3%) thường được sử dụng an toàn trong y tế và gia dụng. Tuy nhiên, H2O2 ở nồng độ cao có thể gây nguy hiểm và cần được sử dụng cẩn thận.
2. MnO2 có tái sử dụng được không sau phản ứng?
Có, MnO2 là chất xúc tác và không bị tiêu thụ trong phản ứng, do đó có thể được thu hồi và tái sử dụng.
3. Phản ứng H2O2 + MnO2 có xảy ra ở nhiệt độ thấp không?
Có, phản ứng vẫn xảy ra ở nhiệt độ thấp, nhưng tốc độ phản ứng sẽ chậm hơn so với nhiệt độ cao.
4. Có thể thay thế MnO2 bằng chất xúc tác nào khác không?
Có, có thể sử dụng các kim loại chuyển tiếp hoặc enzyme catalase làm chất xúc tác thay thế.
5. Tại sao khi cho MnO2 vào H2O2 lại thấy sủi bọt?
Sủi bọt là do khí oxy (O2) được giải phóng trong quá trình phân hủy H2O2.
6. H2O2 có tác dụng gì trong việc làm sạch vết thương?
H2O2 có tác dụng diệt khuẩn và làm sạch vết thương bằng cách oxy hóa các tế bào vi khuẩn và loại bỏ các mảnh vụn.
7. MnO2 có màu gì?
MnO2 có màu đen hoặc nâu đen.
8. H2O2 có mùi không?
H2O2 nguyên chất không có mùi, nhưng dung dịch H2O2 loãng có thể có mùi hơi hắc.
9. Làm thế nào để bảo quản H2O2 an toàn?
H2O2 nên được bảo quản trong容器 kín, ở nơi thoáng mát và tránh ánh sáng trực tiếp.
10. Phản ứng H2O2 + MnO2 có ứng dụng gì trong công nghiệp?
Phản ứng này được sử dụng trong sản xuất oxy, tẩy trắng và xử lý nước thải.
Bạn đang gặp khó khăn trong việc tìm kiếm thông tin chính xác và dễ hiểu về hóa học? Đừng lo lắng, CAUHOI2025.EDU.VN luôn sẵn sàng giúp đỡ! Với đội ngũ chuyên gia giàu kinh nghiệm và nguồn tài liệu đáng tin cậy, chúng tôi cam kết cung cấp cho bạn những câu trả lời rõ ràng, súc tích và được nghiên cứu kỹ lưỡng. Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá thêm nhiều kiến thức hữu ích và đặt câu hỏi của bạn!
Thông tin liên hệ của CAUHOI2025.EDU.VN:
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN
