So Sánh Tính Kim Loại Của Các Nguyên Tố: Al, Ca, Rb?
Bạn đang gặp khó khăn trong việc So Sánh Tính Kim Loại của các nguyên tố hóa học? CAUHOI2025.EDU.VN sẽ giúp bạn hiểu rõ cách xác định và so sánh tính kim loại một cách dễ dàng và chính xác nhất. Bài viết này sẽ cung cấp kiến thức nền tảng, phương pháp so sánh, và các ví dụ minh họa, giúp bạn tự tin giải quyết mọi bài tập liên quan đến tính kim loại. Khám phá ngay để nắm vững kiến thức hóa học!
1. Tính Kim Loại Là Gì?
Tính kim loại là khả năng một nguyên tử nhường electron để tạo thành ion dương (cation). Nguyên tố nào càng dễ nhường electron thì tính kim loại càng mạnh. Tính kim loại thường thể hiện qua các đặc điểm như dẫn điện, dẫn nhiệt tốt, có ánh kim, dễ dát mỏng và kéo sợi. Theo Giáo sư Trần Văn Ơn, Đại học Quốc gia Hà Nội, “Tính kim loại là một trong những tính chất cơ bản của vật chất, quyết định nhiều ứng dụng quan trọng trong công nghiệp và đời sống.”
1.1. Định Nghĩa Tính Kim Loại Theo Quan Điểm Hóa Học
Theo quan điểm hóa học, tính kim loại được định nghĩa dựa trên khả năng một nguyên tử mất electron để tạo thành ion dương. Các nguyên tố kim loại có xu hướng nhường electron ở lớp vỏ ngoài cùng để đạt cấu hình electron bền vững hơn. Quá trình này dễ dàng xảy ra ở các kim loại mạnh, do đó chúng có tính khử mạnh.
1.2. Các Yếu Tố Ảnh Hưởng Đến Tính Kim Loại
Có hai yếu tố chính ảnh hưởng đến tính kim loại của một nguyên tố:
- Bán kính nguyên tử: Bán kính nguyên tử càng lớn, electron lớp ngoài cùng càng dễ bị mất do lực hút giữa hạt nhân và electron giảm. Vì vậy, bán kính nguyên tử lớn thường đi kèm với tính kim loại mạnh.
- Độ âm điện: Độ âm điện là khả năng một nguyên tử hút electron về phía mình. Độ âm điện càng nhỏ, khả năng nhường electron càng cao, do đó tính kim loại càng mạnh.
Theo đó, các kim loại kiềm (nhóm IA) có bán kính nguyên tử lớn và độ âm điện nhỏ nên chúng là những kim loại mạnh nhất.
2. Xu Hướng Biến Đổi Tính Kim Loại Trong Bảng Tuần Hoàn
Tính kim loại của các nguyên tố biến đổi theo quy luật nhất định trong bảng tuần hoàn. Nắm vững quy luật này giúp chúng ta dễ dàng so sánh tính kim loại giữa các nguyên tố.
2.1. Trong Một Chu Kỳ
Trong một chu kỳ, khi điện tích hạt nhân tăng dần (từ trái sang phải), bán kính nguyên tử giảm và độ âm điện tăng. Do đó, tính kim loại giảm dần từ trái sang phải. Ví dụ, trong chu kỳ 3, tính kim loại giảm dần theo thứ tự: Na > Mg > Al.
2.2. Trong Một Nhóm
Trong một nhóm, khi điện tích hạt nhân tăng dần (từ trên xuống dưới), bán kính nguyên tử tăng và độ âm điện giảm. Do đó, tính kim loại tăng dần từ trên xuống dưới. Ví dụ, trong nhóm IA, tính kim loại tăng dần theo thứ tự: Li < Na < K < Rb < Cs.
2.3. Ảnh Hưởng Của Cấu Hình Electron
Cấu hình electron cũng đóng vai trò quan trọng trong việc xác định tính kim loại. Các nguyên tố có cấu hình electron gần giống khí hiếm (dễ dàng đạt được cấu hình bền vững bằng cách nhường hoặc nhận electron) thường có tính kim loại hoặc phi kim mạnh. Ví dụ, các kim loại kiềm có 1 electron ở lớp ngoài cùng (ns1) dễ dàng nhường electron để đạt cấu hình bền vững của khí hiếm, do đó chúng có tính kim loại rất mạnh.
3. Phương Pháp So Sánh Tính Kim Loại
Để so sánh tính kim loại của các nguyên tố, chúng ta có thể áp dụng các phương pháp sau:
3.1. Dựa Vào Vị Trí Trong Bảng Tuần Hoàn
Đây là phương pháp đơn giản và phổ biến nhất. Chúng ta xác định vị trí của các nguyên tố trong bảng tuần hoàn (chu kỳ và nhóm), sau đó áp dụng quy luật biến đổi tính kim loại để so sánh.
3.1.1. Các Bước Thực Hiện
- Xác định vị trí: Xác định chu kỳ và nhóm của các nguyên tố cần so sánh.
- So sánh trong cùng chu kỳ: Nếu các nguyên tố thuộc cùng một chu kỳ, tính kim loại giảm dần từ trái sang phải.
- So sánh trong cùng nhóm: Nếu các nguyên tố thuộc cùng một nhóm, tính kim loại tăng dần từ trên xuống dưới.
- So sánh khác chu kỳ và nhóm: Nếu các nguyên tố không cùng chu kỳ và nhóm, cần so sánh thông qua một nguyên tố trung gian hoặc dựa vào cấu hình electron.
3.1.2. Ví Dụ Minh Họa
So sánh tính kim loại của Na, Mg, Al:
- Na, Mg, Al đều thuộc chu kỳ 3.
- Trong chu kỳ 3, tính kim loại giảm dần theo thứ tự: Na > Mg > Al.
So sánh tính kim loại của Li, Na, K:
- Li, Na, K đều thuộc nhóm IA.
- Trong nhóm IA, tính kim loại tăng dần theo thứ tự: Li < Na < K.
3.2. Dựa Vào Cấu Hình Electron
Phương pháp này áp dụng khi các nguyên tố không cùng chu kỳ và nhóm, hoặc khi cần so sánh chi tiết hơn.
3.2.1. Các Bước Thực Hiện
- Viết cấu hình electron: Viết cấu hình electron của các nguyên tố cần so sánh.
- Xác định khả năng nhường electron: Xem xét khả năng nhường electron của từng nguyên tố để đạt cấu hình bền vững.
- So sánh: Nguyên tố nào càng dễ nhường electron thì tính kim loại càng mạnh.
3.2.2. Ví Dụ Minh Họa
So sánh tính kim loại của K (Z=19) và Ca (Z=20):
- Cấu hình electron của K: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
- Cấu hình electron của Ca: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s²
K dễ dàng nhường 1 electron ở lớp 4s để đạt cấu hình bền vững của khí hiếm Argon. Ca cần nhường 2 electron, quá trình này khó khăn hơn. Do đó, K có tính kim loại mạnh hơn Ca.
3.3. Dựa Vào Thế Điện Cực Chuẩn
Thế điện cực chuẩn (E°) là thước đo khả năng khử của một chất. Chất nào có thế điện cực chuẩn càng âm thì tính khử càng mạnh, tức là tính kim loại càng mạnh.
3.3.1. Các Bước Thực Hiện
- Tìm giá trị thế điện cực chuẩn: Tra bảng thế điện cực chuẩn của các nguyên tố cần so sánh.
- So sánh: Nguyên tố nào có thế điện cực chuẩn càng âm thì tính kim loại càng mạnh.
3.3.2. Ví Dụ Minh Họa
So sánh tính kim loại của Zn (E° = -0.76V) và Cu (E° = +0.34V):
- Zn có thế điện cực chuẩn âm hơn Cu.
- Do đó, Zn có tính kim loại mạnh hơn Cu.
3.4. Sử Dụng Nguyên Tố Trung Gian
Khi so sánh tính kim loại của các nguyên tố không cùng chu kỳ và nhóm, việc sử dụng một nguyên tố trung gian có thể giúp đơn giản hóa quá trình so sánh.
3.4.1. Các Bước Thực Hiện
- Chọn nguyên tố trung gian: Chọn một nguyên tố có vị trí trung gian giữa các nguyên tố cần so sánh, sao cho có thể so sánh trực tiếp với từng nguyên tố còn lại.
- So sánh với nguyên tố trung gian: So sánh tính kim loại của từng nguyên tố cần so sánh với nguyên tố trung gian.
- Kết luận: Dựa vào kết quả so sánh với nguyên tố trung gian để đưa ra kết luận về thứ tự tính kim loại của các nguyên tố ban đầu.
3.4.2. Ví Dụ Minh Họa
So sánh tính kim loại của Ca và Al:
- Chọn Mg làm nguyên tố trung gian (Mg cùng nhóm với Ca và cùng chu kỳ với Al).
- So sánh Ca và Mg: Ca nằm dưới Mg trong nhóm IIA, do đó Ca > Mg.
- So sánh Mg và Al: Mg nằm trước Al trong chu kỳ 3, do đó Mg > Al.
- Kết luận: Ca > Mg > Al. Vậy tính kim loại của Ca mạnh hơn Al.
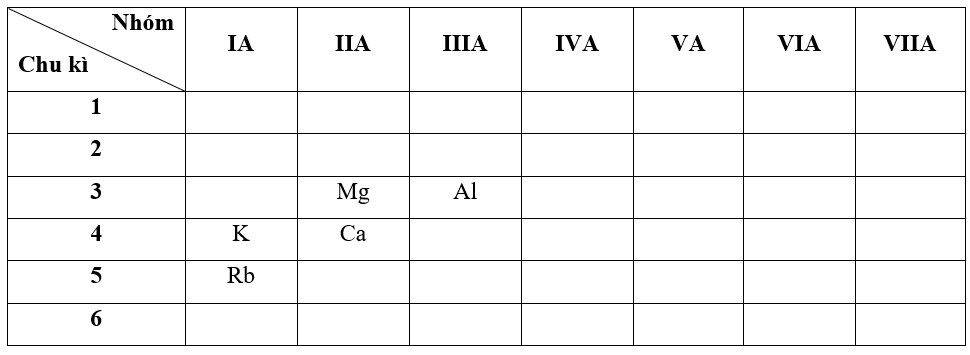
4. So Sánh Tính Kim Loại Của Al, Ca, Rb
Để so sánh tính kim loại của Al, Ca, Rb, ta áp dụng các phương pháp đã trình bày ở trên.
4.1. Xác Định Vị Trí Trong Bảng Tuần Hoàn
- Al (Nhôm): Chu kỳ 3, nhóm IIIA.
- Ca (Canxi): Chu kỳ 4, nhóm IIA.
- Rb (Rubidi): Chu kỳ 5, nhóm IA.

Alt text: Vị trí của Al, Ca, Rb trong bảng tuần hoàn, thể hiện sự khác biệt về chu kỳ và nhóm.
4.2. So Sánh Thông Qua Nguyên Tố Trung Gian
Vì Al, Ca, Rb không cùng chu kỳ và nhóm, ta sử dụng nguyên tố trung gian để so sánh:
- So sánh Rb và Ca:
- Chọn K (Kali) làm nguyên tố trung gian (K cùng chu kỳ với Ca và cùng nhóm với Rb).
- Rb nằm dưới K trong nhóm IA, do đó Rb > K.
- K nằm trước Ca trong chu kỳ 4, do đó K > Ca.
- Vậy Rb > K > Ca => Rb > Ca.
- So sánh Ca và Al:
- Chọn Mg (Magie) làm nguyên tố trung gian (Mg cùng nhóm với Ca và cùng chu kỳ với Al).
- Ca nằm dưới Mg trong nhóm IIA, do đó Ca > Mg.
- Mg nằm trước Al trong chu kỳ 3, do đó Mg > Al.
- Vậy Ca > Mg > Al => Ca > Al.
4.3. Kết Luận
Từ các so sánh trên, ta có thứ tự tính kim loại tăng dần như sau: Al < Ca < Rb.
5. Ứng Dụng Của Tính Kim Loại Trong Thực Tế
Tính kim loại là một tính chất quan trọng và có nhiều ứng dụng trong thực tế:
5.1. Trong Công Nghiệp
- Sản xuất vật liệu: Kim loại được sử dụng rộng rãi trong sản xuất các vật liệu xây dựng, máy móc, thiết bị điện tử, và nhiều sản phẩm công nghiệp khác.
- Chế tạo hợp kim: Các hợp kim được tạo ra từ việc kết hợp các kim loại khác nhau, giúp cải thiện tính chất của vật liệu như độ bền, khả năng chống ăn mòn, và độ dẫn điện. Ví dụ, thép là hợp kim của sắt và carbon, được sử dụng rộng rãi trong xây dựng và sản xuất ô tô.
- Điện tử: Kim loại như đồng và nhôm được sử dụng làm dây dẫn điện trong các thiết bị điện tử và hệ thống điện.
5.2. Trong Đời Sống
- Đồ gia dụng: Nhiều đồ gia dụng như nồi, chảo, dao, kéo được làm từ kim loại do tính bền, dẫn nhiệt tốt, và dễ gia công.
- Trang sức: Vàng, bạc, và bạch kim được sử dụng làm trang sức nhờ vẻ đẹp, độ bền, và khả năng chống ăn mòn.
- Y học: Kim loại như titan được sử dụng trong các thiết bị cấy ghép y tế do tính tương thích sinh học cao và khả năng chống ăn mòn.
5.3. Nghiên Cứu Khoa Học
- Pin và ắc quy: Kim loại đóng vai trò quan trọng trong các loại pin và ắc quy, cung cấp năng lượng cho các thiết bị di động, xe điện, và hệ thống lưu trữ năng lượng.
- Chất xúc tác: Nhiều kim loại được sử dụng làm chất xúc tác trong các phản ứng hóa học, giúp tăng tốc độ phản ứng và cải thiện hiệu suất.
6. Câu Hỏi Thường Gặp (FAQ) Về Tính Kim Loại
1. Tính kim loại là gì?
Tính kim loại là khả năng một nguyên tử nhường electron để tạo thành ion dương (cation).
2. Yếu tố nào ảnh hưởng đến tính kim loại?
Bán kính nguyên tử và độ âm điện là hai yếu tố chính ảnh hưởng đến tính kim loại.
3. Tính kim loại biến đổi như thế nào trong bảng tuần hoàn?
Trong một chu kỳ, tính kim loại giảm dần từ trái sang phải. Trong một nhóm, tính kim loại tăng dần từ trên xuống dưới.
4. Làm thế nào để so sánh tính kim loại của các nguyên tố?
Có thể so sánh dựa vào vị trí trong bảng tuần hoàn, cấu hình electron, thế điện cực chuẩn, hoặc sử dụng nguyên tố trung gian.
5. Kim loại nào có tính kim loại mạnh nhất?
Các kim loại kiềm (nhóm IA) là những kim loại mạnh nhất.
6. Tại sao kim loại kiềm lại có tính kim loại mạnh?
Kim loại kiềm có bán kính nguyên tử lớn và độ âm điện nhỏ, dễ dàng nhường electron để đạt cấu hình bền vững.
7. Tính kim loại có ứng dụng gì trong thực tế?
Tính kim loại có nhiều ứng dụng trong công nghiệp, đời sống, và nghiên cứu khoa học, từ sản xuất vật liệu, chế tạo hợp kim, đến ứng dụng trong điện tử và y học.
8. Thế điện cực chuẩn là gì?
Thế điện cực chuẩn là thước đo khả năng khử của một chất, được sử dụng để so sánh tính kim loại.
9. Nguyên tố trung gian là gì và được sử dụng như thế nào trong so sánh tính kim loại?
Nguyên tố trung gian là một nguyên tố được sử dụng để so sánh tính kim loại của hai nguyên tố không cùng chu kỳ và nhóm, giúp đơn giản hóa quá trình so sánh.
10. Làm thế nào để xác định vị trí của một nguyên tố trong bảng tuần hoàn?
Vị trí của một nguyên tố trong bảng tuần hoàn được xác định dựa trên số hiệu nguyên tử (số proton trong hạt nhân) và cấu hình electron của nguyên tố đó.
7. CAUHOI2025.EDU.VN – Nguồn Thông Tin Hóa Học Tin Cậy
Bạn đang tìm kiếm một nguồn thông tin hóa học đáng tin cậy và dễ hiểu? Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay! Chúng tôi cung cấp các bài viết chi tiết, giải thích rõ ràng về các khái niệm hóa học, giúp bạn nắm vững kiến thức và tự tin giải quyết mọi bài tập.
Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Thông tin chính xác và được kiểm chứng: Tất cả các bài viết đều được biên soạn bởi đội ngũ chuyên gia và giáo viên giàu kinh nghiệm, đảm bảo tính chính xác và khoa học.
- Giải thích dễ hiểu: Các khái niệm hóa học phức tạp được giải thích một cách rõ ràng, dễ hiểu, phù hợp với mọi đối tượng.
- Ví dụ minh họa: Mỗi bài viết đều đi kèm với các ví dụ minh họa cụ thể, giúp bạn hiểu rõ hơn về cách áp dụng kiến thức vào thực tế.
- Cập nhật thường xuyên: Chúng tôi liên tục cập nhật các bài viết mới nhất về các chủ đề hóa học khác nhau, giúp bạn luôn nắm bắt được những thông tin mới nhất.
Nếu bạn có bất kỳ câu hỏi hoặc thắc mắc nào về hóa học, đừng ngần ngại liên hệ với chúng tôi tại CAUHOI2025.EDU.VN. Chúng tôi luôn sẵn lòng giúp đỡ bạn!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CAUHOI2025.EDU.VN
Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá thêm nhiều kiến thức hóa học thú vị và bổ ích! Nắm vững kiến thức về tính kim loại và các nguyên tố hóa học khác sẽ giúp bạn tự tin hơn trong học tập và công việc. Đừng bỏ lỡ cơ hội trở thành chuyên gia hóa học với CauHoi2025.EDU.VN!