Phản Ứng Oxi Hóa Khử Xảy Ra Theo Chiều Nào? Giải Thích Chi Tiết
Bạn có bao giờ tự hỏi, tại sao pin điện thoại có thể cung cấp năng lượng cho thiết bị của bạn hoạt động? Hay tại sao một số kim loại lại bị ăn mòn theo thời gian? Tất cả những hiện tượng này đều liên quan đến Phản ứng Oxi Hóa Khử Xảy Ra Theo Chiều Nào. CAUHOI2025.EDU.VN sẽ giải thích chi tiết về vấn đề này, giúp bạn hiểu rõ bản chất của nó.
Phản Ứng Oxi Hóa Khử Là Gì?
Phản ứng oxi hóa khử (hay còn gọi là phản ứng redox) là loại phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của các nguyên tử. Đây là một quá trình quan trọng trong nhiều lĩnh vực, từ công nghiệp, sinh học đến đời sống hàng ngày.
Oxi Hóa
Oxi hóa là quá trình một nguyên tử, ion hoặc phân tử mất electron, dẫn đến sự tăng số oxi hóa. Chất bị oxi hóa được gọi là chất khử (chất cho electron).
Khử
Khử là quá trình một nguyên tử, ion hoặc phân tử nhận electron, dẫn đến sự giảm số oxi hóa. Chất bị khử được gọi là chất oxi hóa (chất nhận electron).
Ví dụ: Xét phản ứng giữa kẽm (Zn) và đồng (II) sunfat (CuSO4):
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
- Kẽm (Zn) mất 2 electron để trở thành ion kẽm (Zn2+), số oxi hóa tăng từ 0 lên +2: Zn → Zn2+ + 2e– (oxi hóa)
- Đồng (II) (Cu2+) nhận 2 electron để trở thành đồng kim loại (Cu), số oxi hóa giảm từ +2 xuống 0: Cu2+ + 2e– → Cu (khử)
Trong phản ứng này, kẽm là chất khử và đồng (II) là chất oxi hóa.
Chiều Của Phản Ứng Oxi Hóa Khử
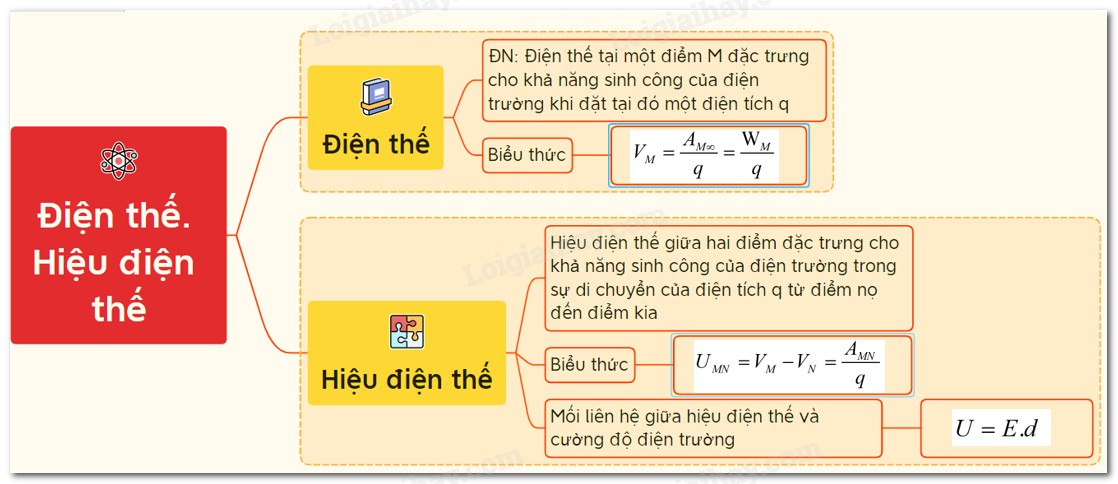
Vậy, phản ứng oxi hóa khử xảy ra theo chiều nào? Chiều của phản ứng oxi hóa khử được quyết định bởi thế điện cực chuẩn (Eo) của các cặp oxi hóa khử. Thế điện cực chuẩn là thước đo khả năng một chất nhường hoặc nhận electron so với điện cực hydro chuẩn.
Thế Điện Cực Chuẩn (Eo)
- Thế điện cực chuẩn được đo ở điều kiện tiêu chuẩn (25°C, áp suất 1 atm, nồng độ 1M).
- Giá trị Eo càng dương, chất oxi hóa càng mạnh (dễ nhận electron).
- Giá trị Eo càng âm, chất khử càng mạnh (dễ nhường electron).
Quy tắc: Trong một phản ứng oxi hóa khử, phản ứng sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn. Nói cách khác, phản ứng tự xảy ra theo chiều tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
Ví dụ: Xét phản ứng giữa kẽm (Zn) và đồng (II) sunfat (CuSO4) như trên. Ta có thế điện cực chuẩn:
- Eo(Cu2+/Cu) = +0.34 V
- Eo(Zn2+/Zn) = -0.76 V
Vì Eo(Cu2+/Cu) > Eo(Zn2+/Zn), nên Cu2+ là chất oxi hóa mạnh hơn và Zn là chất khử mạnh hơn. Do đó, phản ứng xảy ra theo chiều Zn bị oxi hóa và Cu2+ bị khử.
Cách Xác Định Chiều Phản Ứng Dựa Vào Thế Điện Cực Chuẩn
- Xác định các cặp oxi hóa khử: Xác định các chất tham gia phản ứng và các dạng oxi hóa, khử tương ứng của chúng.
- Tìm thế điện cực chuẩn: Tra bảng thế điện cực chuẩn để tìm giá trị Eo của các cặp oxi hóa khử.
- So sánh thế điện cực chuẩn: So sánh giá trị Eo của các cặp oxi hóa khử. Phản ứng sẽ xảy ra theo chiều chất oxi hóa có Eo lớn hơn sẽ oxi hóa chất khử có Eo nhỏ hơn.
- Viết phương trình phản ứng: Dựa vào chiều phản ứng đã xác định, viết phương trình phản ứng hoàn chỉnh.
Các Yếu Tố Ảnh Hưởng Đến Chiều Phản Ứng Oxi Hóa Khử
Ngoài thế điện cực chuẩn, một số yếu tố khác cũng có thể ảnh hưởng đến chiều của phản ứng oxi hóa khử:
Nồng Độ
Nồng độ của các chất phản ứng và sản phẩm có thể ảnh hưởng đến thế điện cực. Theo phương trình Nernst, thế điện cực thay đổi theo nồng độ:
E = Eo – (RT/nF) * lnQ
Trong đó:
- E là thế điện cực thực tế
- Eo là thế điện cực chuẩn
- R là hằng số khí lý tưởng (8.314 J/mol.K)
- T là nhiệt độ (K)
- n là số electron trao đổi
- F là hằng số Faraday (96485 C/mol)
- Q là thương số phản ứng
Thay đổi nồng độ có thể làm thay đổi giá trị E, và do đó ảnh hưởng đến chiều của phản ứng.
Nhiệt Độ
Nhiệt độ cũng ảnh hưởng đến thế điện cực theo phương trình Nernst. Thay đổi nhiệt độ có thể làm thay đổi giá trị E và do đó ảnh hưởng đến chiều của phản ứng.
pH
Đối với các phản ứng oxi hóa khử xảy ra trong môi trường dung dịch, pH có thể ảnh hưởng đến thế điện cực của các chất tham gia. Đặc biệt, các phản ứng có sự tham gia của ion H+ hoặc OH– sẽ chịu ảnh hưởng lớn của pH.
Chất Tạo Phức
Sự có mặt của các chất tạo phức có thể làm thay đổi nồng độ của các ion kim loại tự do trong dung dịch, từ đó ảnh hưởng đến thế điện cực và chiều của phản ứng.
Ứng Dụng Của Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử có rất nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
Pin Điện Hóa
Pin điện hóa hoạt động dựa trên nguyên tắc của phản ứng oxi hóa khử. Năng lượng hóa học từ phản ứng oxi hóa khử được chuyển đổi thành năng lượng điện. Ví dụ, pin điện thoại, pin ô tô đều sử dụng phản ứng oxi hóa khử để tạo ra dòng điện. Theo một nghiên cứu của Đại học Bách Khoa Hà Nội năm 2023, việc phát triển các loại pin mới với hiệu suất cao và thân thiện với môi trường là một lĩnh vực nghiên cứu quan trọng.
Ăn Mòn Kim Loại
Ăn mòn kim loại là một quá trình oxi hóa khử, trong đó kim loại bị oxi hóa bởi các tác nhân trong môi trường như oxi, nước, axit. Ví dụ, sắt bị gỉ khi tiếp xúc với không khí ẩm.
Sản Xuất Hóa Chất
Nhiều quá trình sản xuất hóa chất sử dụng phản ứng oxi hóa khử. Ví dụ, sản xuất axit sulfuric (H2SO4) từ lưu huỳnh (S) thông qua quá trình oxi hóa.
Xử Lý Nước
Phản ứng oxi hóa khử được sử dụng trong xử lý nước để loại bỏ các chất ô nhiễm. Ví dụ, clo được sử dụng để oxi hóa và tiêu diệt vi khuẩn trong nước.
Điện Phân
Điện phân là quá trình sử dụng dòng điện để thực hiện các phản ứng oxi hóa khử không tự xảy ra. Điện phân được sử dụng trong nhiều ứng dụng, như sản xuất nhôm, clo, và mạ điện.
Ví Dụ Minh Họa Về Chiều Phản Ứng Oxi Hóa Khử Trong Thực Tế
Pin Điện Thoại
Pin điện thoại sử dụng phản ứng oxi hóa khử để tạo ra dòng điện. Trong pin lithium-ion, lithium kim loại bị oxi hóa ở cực âm, nhường electron cho mạch ngoài. Các electron này di chuyển đến cực dương, nơi chúng khử các ion kim loại khác. Phản ứng xảy ra theo chiều tự phát, tạo ra dòng điện cung cấp năng lượng cho điện thoại.
Ăn Mòn Sắt
Khi sắt tiếp xúc với không khí ẩm, nó bị oxi hóa thành oxit sắt (gỉ sắt). Phản ứng xảy ra theo chiều tự phát, do sắt có thế điện cực thấp hơn so với oxi trong không khí. Gỉ sắt là một lớp xốp, không bảo vệ sắt khỏi bị ăn mòn tiếp, do đó quá trình ăn mòn tiếp tục diễn ra.
Quá Trình Quang Hợp Ở Thực Vật
Quang hợp là quá trình thực vật sử dụng năng lượng ánh sáng để chuyển đổi CO2 và H2O thành glucose và O2. Quá trình này bao gồm cả phản ứng oxi hóa và khử. Nước bị oxi hóa để tạo ra oxi, trong khi CO2 bị khử để tạo ra glucose.
Các Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng Oxi Hóa Khử
1. Phản ứng oxi hóa khử có vai trò gì trong đời sống?
Phản ứng oxi hóa khử đóng vai trò quan trọng trong nhiều quá trình sinh học (hô hấp, quang hợp), công nghiệp (sản xuất hóa chất, luyện kim), và đời sống hàng ngày (pin điện, ăn mòn kim loại).
2. Làm thế nào để xác định chất oxi hóa và chất khử trong một phản ứng?
Chất oxi hóa là chất nhận electron (số oxi hóa giảm), chất khử là chất nhường electron (số oxi hóa tăng).
3. Thế điện cực chuẩn là gì?
Thế điện cực chuẩn là thước đo khả năng một chất nhường hoặc nhận electron so với điện cực hydro chuẩn ở điều kiện tiêu chuẩn.
4. Yếu tố nào ảnh hưởng đến chiều của phản ứng oxi hóa khử?
Nồng độ, nhiệt độ, pH, và chất tạo phức có thể ảnh hưởng đến chiều của phản ứng oxi hóa khử.
5. Tại sao pin lại hết điện?
Pin hết điện khi các chất phản ứng trong pin đã bị tiêu thụ hết, hoặc khi các phản ứng phụ làm giảm hiệu suất của pin.
6. Làm thế nào để bảo vệ kim loại khỏi bị ăn mòn?
Có nhiều phương pháp bảo vệ kim loại khỏi bị ăn mòn, như sơn phủ, mạ điện, sử dụng chất ức chế ăn mòn, hoặc sử dụng kim loại chống ăn mòn.
7. Phản ứng oxi hóa khử có liên quan đến môi trường như thế nào?
Phản ứng oxi hóa khử có vai trò quan trọng trong các quá trình tự nhiên như chu trình nitơ, chu trình cacbon, và trong xử lý ô nhiễm môi trường.
8. Điện phân là gì và nó được sử dụng để làm gì?
Điện phân là quá trình sử dụng dòng điện để thực hiện các phản ứng oxi hóa khử không tự xảy ra. Nó được sử dụng trong sản xuất nhôm, clo, và mạ điện.
9. Tại sao cần phải cân bằng phương trình phản ứng oxi hóa khử?
Cân bằng phương trình phản ứng oxi hóa khử đảm bảo tuân thủ định luật bảo toàn electron (số electron nhường bằng số electron nhận) và định luật bảo toàn khối lượng.
10. Có những loại pin nào sử dụng phản ứng oxi hóa khử?
Có nhiều loại pin sử dụng phản ứng oxi hóa khử, như pin lithium-ion, pin chì-axit, pin alkaline, và pin nhiên liệu.
Kết Luận
Hiểu rõ về phản ứng oxi hóa khử xảy ra theo chiều nào là rất quan trọng để nắm bắt các quá trình hóa học diễn ra xung quanh chúng ta. Từ việc tạo ra năng lượng trong pin đến quá trình ăn mòn kim loại, phản ứng oxi hóa khử đóng vai trò then chốt. Mong rằng bài viết này của CAUHOI2025.EDU.VN đã cung cấp cho bạn những kiến thức hữu ích và dễ hiểu về chủ đề này.
Bạn đang gặp khó khăn trong việc giải các bài tập về phản ứng oxi hóa khử? Bạn muốn tìm hiểu sâu hơn về ứng dụng của chúng trong thực tế? Hãy truy cập CauHoi2025.EDU.VN ngay hôm nay để khám phá thêm nhiều kiến thức thú vị và bổ ích! Chúng tôi luôn sẵn sàng giải đáp mọi thắc mắc của bạn. Liên hệ với chúng tôi tại địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc qua số điện thoại +84 2435162967.

Alt: Pin điện thoại đang được sạc, minh họa ứng dụng của phản ứng oxi hóa khử trong việc tích trữ năng lượng.