**Nhóm B Bao Gồm Các Nguyên Tố Nào? Giải Đáp Chi Tiết Từ A-Z**
Bạn đang tìm kiếm thông tin về nhóm B trong bảng tuần hoàn các nguyên tố hóa học? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp cho bạn một cái nhìn toàn diện về nhóm B, bao gồm định nghĩa, các nguyên tố cấu thành, đặc điểm chung và ứng dụng quan trọng. Khám phá ngay để nắm vững kiến thức hóa học một cách dễ dàng!
Giới thiệu:
Bảng tuần hoàn các nguyên tố hóa học là một công cụ vô cùng quan trọng trong hóa học, giúp chúng ta hệ thống hóa và hiểu rõ hơn về các nguyên tố. Trong đó, nhóm B là một nhóm lớn và đa dạng, bao gồm nhiều nguyên tố có vai trò quan trọng trong đời sống và công nghiệp.
1. Tổng Quan Về Bảng Tuần Hoàn Các Nguyên Tố Hóa Học
Trước khi đi sâu vào tìm hiểu “Nhóm B Bao Gồm Các Nguyên Tố” nào, chúng ta hãy cùng nhau điểm qua những nguyên tắc cơ bản cấu thành nên bảng tuần hoàn:
- Nguyên tắc 1: Các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân.
- Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kỳ.
- Nguyên tắc 3: Các nguyên tố có số electron hóa trị tương tự nhau được xếp thành một cột, gọi là nhóm. Electron hóa trị là các electron có khả năng tham gia vào quá trình hình thành liên kết hóa học, thường là các electron ở lớp ngoài cùng hoặc phân lớp gần ngoài cùng chưa bão hòa.
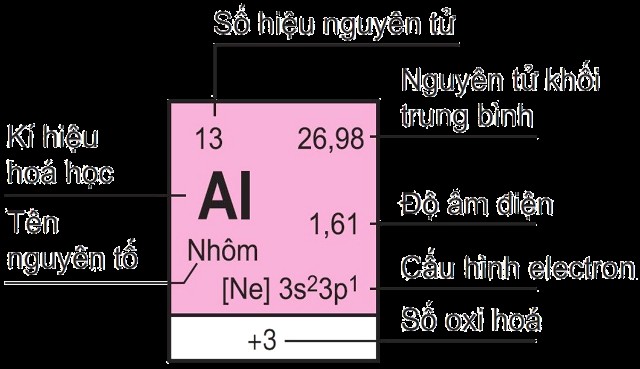
1.1. Ô Nguyên Tố
Mỗi nguyên tố hóa học được đặt trong một ô riêng biệt trong bảng tuần hoàn. Số thứ tự của ô nguyên tố trùng với số hiệu nguyên tử của nguyên tố đó.

1.2. Chu Kỳ
a) Định Nghĩa
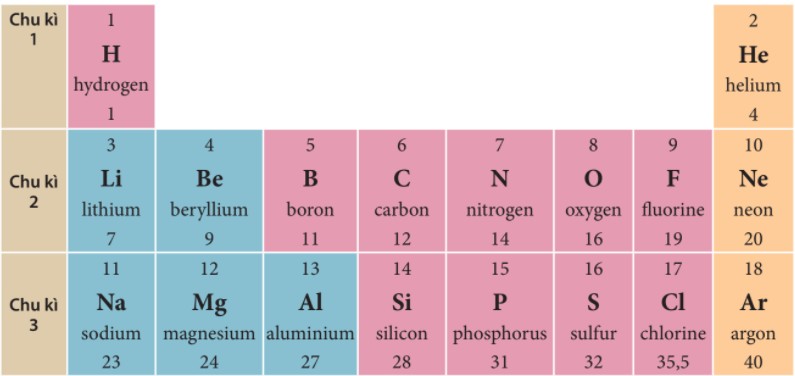
Chu kỳ là một dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều tăng dần điện tích hạt nhân từ trái sang phải.
b) Giới Thiệu Các Chu Kỳ
Bảng tuần hoàn hiện đại có 7 chu kỳ:
- Chu kỳ 1: Gồm 2 nguyên tố, từ Hydro (H, Z=1) đến Heli (He, Z=2).
- Chu kỳ 2: Gồm 8 nguyên tố, từ Liti (Li, Z=3) đến Neon (Ne, Z=10).
- Chu kỳ 3: Gồm 8 nguyên tố, từ Natri (Na, Z=11) đến Argon (Ar, Z=18).
- Chu kỳ 4: Gồm 18 nguyên tố, từ Kali (K, Z=19) đến Krypton (Kr, Z=36).
- Chu kỳ 5: Gồm 18 nguyên tố, từ Rubidi (Rb, Z=37) đến Xenon (Xe, Z=54).
- Chu kỳ 6: Gồm 32 nguyên tố, từ Cesium (Cs, Z=55) đến Radon (Rn, Z=86).
- Chu kỳ 7: Bắt đầu từ Francium (Fr, Z=87) và hiện tại kéo dài đến nguyên tố có Z=118 (Oganesson), đây là một chu kỳ chưa hoàn chỉnh.
c) Phân Loại Chu Kỳ
- Chu kỳ nhỏ: Chu kỳ 1, 2 và 3.
- Chu kỳ lớn: Chu kỳ 4, 5, 6 và 7.
d) Nhận Xét Chung
- Các nguyên tố trong cùng một chu kỳ có số lớp electron bằng nhau và bằng chính số thứ tự của chu kỳ.
- Mỗi chu kỳ bắt đầu bằng một kim loại kiềm (trừ chu kỳ 1) và kết thúc bằng một khí hiếm. Gần cuối chu kỳ thường là các halogen.
- Hai hàng cuối của bảng tuần hoàn là hai họ nguyên tố đặc biệt: họ Lanthan và họ Actini.
- Họ Lanthan: Thuộc chu kỳ 6, gồm 14 nguyên tố đứng sau Lanthan (La, Z=57).
- Họ Actini: Thuộc chu kỳ 7, gồm 14 nguyên tố đứng sau Actini (Ac, Z=89).
1.3. Nhóm Nguyên Tố
a) Định Nghĩa
Nhóm nguyên tố là tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp chung vào một cột.
b) Phân Loại
Bảng tuần hoàn chia thành 8 nhóm A và 8 nhóm B, được đánh số từ IA đến VIIIA và từ IB đến VIIIB. Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
Nguyên tử của các nguyên tố thuộc cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (ngoại trừ hai cột cuối của nhóm VIIIB).
1.4. Khối Nguyên Tố
- Khối s: Gồm các nguyên tố thuộc nhóm IA và IIA.
- Khối p: Gồm các nguyên tố thuộc nhóm IIIA đến VIIIA (trừ Heli).
- Nhóm A: Chỉ bao gồm các nguyên tố s và p.
- Khối d: Gồm các nguyên tố thuộc nhóm B.
- Khối f: Gồm các nguyên tố xếp ở hai hàng cuối của bảng tuần hoàn (họ Lanthan và Actini).
- Nhóm B: Bao gồm các nguyên tố d và f.
2. Nhóm B Bao Gồm Các Nguyên Tố Nào?
Nhóm B trong bảng tuần hoàn bao gồm các nguyên tố thuộc khối d và khối f. Chúng còn được gọi là các kim loại chuyển tiếp. Các nguyên tố này có nhiều hóa trị khác nhau và tạo thành các hợp chất có màu sắc đa dạng.
2.1. Các Nguyên Tố Nhóm B
Dưới đây là danh sách các nguyên tố thuộc nhóm B:
- Nhóm IIIB (3): Scandi (Sc), Ytri (Y), Luteti (Lu), Lawrenci (Lr).
- Nhóm IVB (4): Titan (Ti), Zirconi (Zr), Hafni (Hf), Rutherfordi (Rf).
- Nhóm VB (5): Vanadi (V), Niobi (Nb), Tantali (Ta), Dubni (Db).
- Nhóm VIB (6): Crom (Cr), Molypden (Mo), Wolfram (W), Seaborgi (Sg).
- Nhóm VIIB (7): Mangan (Mn), Techneti (Tc), Rheni (Re), Bohri (Bh).
- Nhóm VIIIB (8, 9, 10): Sắt (Fe), Rutheni (Ru), Osmi (Os), Hassi (Hs), Coban (Co), Rhodi (Rh), Iridi (Ir), Meitneri (Mt), Niken (Ni), Palladi (Pd), Platin (Pt), Darmstadti (Ds).
- Nhóm IB (11): Đồng (Cu), Bạc (Ag), Vàng (Au), Roentgeni (Rg).
- Nhóm IIB (12): Kẽm (Zn), Cadmi (Cd), Thủy ngân (Hg), Copernici (Cn).
Lưu ý: Số trong ngoặc đơn là số thứ tự nhóm theo danh pháp IUPAC.
2.2. Đặc Điểm Chung Của Các Nguyên Tố Nhóm B
- Tính kim loại: Đa số là kim loại, có ánh kim, dẫn điện và dẫn nhiệt tốt. Tuy nhiên, tính chất kim loại biến đổi không đều theo chiều tăng điện tích hạt nhân.
- Nhiều hóa trị: Các nguyên tố nhóm B thường có nhiều hóa trị khác nhau trong các hợp chất, do có sự tham gia của các electron ở lớp d vào liên kết hóa học. Ví dụ, sắt (Fe) có thể có hóa trị II hoặc III.
- Hợp chất có màu: Nhiều hợp chất của các nguyên tố nhóm B có màu sắc đặc trưng, do sự hấp thụ ánh sáng của các ion kim loại chuyển tiếp. Ví dụ, dung dịch muối đồng (Cu2+) thường có màu xanh lam.
- Hoạt tính xúc tác: Nhiều kim loại chuyển tiếp và hợp chất của chúng có hoạt tính xúc tác cao, được sử dụng rộng rãi trong công nghiệp hóa chất. Ví dụ, platin (Pt) được sử dụng làm chất xúc tác trong các bộ chuyển đổi xúc tác của ô tô.
- Cấu hình electron: Các nguyên tố nhóm B có cấu hình electron lớp ngoài cùng là ns1 hoặc ns2 (n là số thứ tự chu kỳ), và phân lớp (n-1)d chứa từ 1 đến 10 electron. Điều này tạo nên sự linh hoạt trong việc hình thành liên kết hóa học.
3. Ứng Dụng Quan Trọng Của Các Nguyên Tố Nhóm B
Các nguyên tố nhóm B có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
- Công nghiệp: Sắt (Fe) là thành phần chính của thép, được sử dụng rộng rãi trong xây dựng, giao thông vận tải và sản xuất máy móc. Titan (Ti) được sử dụng trong ngành hàng không vũ trụ do nhẹ và bền.
- Điện tử: Đồng (Cu) là vật liệu dẫn điện chính trong dây điện và các thiết bị điện tử. Vàng (Au) và bạc (Ag) được sử dụng trong các tiếp điểm điện do khả năng chống ăn mòn cao.
- Y học: Platin (Pt) được sử dụng trong các thuốc điều trị ung thư. Gadolini (Gd) được sử dụng trong các chất cản quang MRI.
- Trang sức: Vàng (Au), bạc (Ag) và platin (Pt) là các kim loại quý được sử dụng rộng rãi trong chế tác trang sức.
- Nông nghiệp: Mangan (Mn), kẽm (Zn) và đồng (Cu) là các nguyên tố vi lượng cần thiết cho sự phát triển của cây trồng.
4. Cách Xác Định Nhóm Của Một Nguyên Tố
4.1. Nhóm A
Nhóm A bao gồm 8 nhóm từ IA đến VIIIA.
Các nguyên tố nhóm A là nguyên tố s và nguyên tố p:
- Nguyên tố s: Nhóm IA (kim loại kiềm, trừ Hydro) và nhóm IIA (kim loại kiềm thổ).
- Nguyên tố p: Từ nhóm IIIA đến VIIIA (ngoại trừ Heli).
Số thứ tự nhóm = Số electron lớp ngoài cùng = Số electron hóa trị
-
Cấu hình electron hóa trị tổng quát:
- nsa npb (điều kiện: 1 ≤ a ≤ 2; 0 ≤ b ≤ 6)
-
Số thứ tự của nhóm A = a + b
- Nếu a + b ≤ 3 → Nguyên tố kim loại
- Nếu 5 ≤ a + b ≤ 7 → Nguyên tố phi kim
- Nếu a + b = 8 → Khí hiếm
Ví dụ:
- Na (Z = 11): 1s2 2s2 2p6 3s1 → thuộc nhóm IA
- O (Z=8): 1s2 2s2 2p4 → thuộc nhóm VIA
4.2. Nhóm B
Nhóm B bao gồm 8 nhóm được đánh số từ nhóm IIIB đến nhóm VIIIB, và nhóm IB đến nhóm IIB theo chiều từ trái sang phải trong bảng tuần hoàn.
Nhóm B bao gồm các nguyên tố của các chu kỳ lớn.
Nhóm B gồm các nguyên tố d và nguyên tố f (thuộc 2 hàng cuối trong bảng).
Số thứ tự nhóm = Số e hóa trị = Số e lớp ngoài cùng (Ngoại trừ: Số e hóa trị = 8, 9, 10 thuộc nhóm VIIIB)
-
Cấu hình e hóa trị của nguyên tố hóa học d:
- (n–1) da nsb (Điều kiện: b = 2; 1 ≤ a ≤ 10)
-
Nếu a + b
- Nếu a + b = 8, 9, 10 thì STT nhóm = 8
- Nếu a + b > 10 thì STT nhóm =(a + b) – 10
5. Ví Dụ Minh Họa
Ví dụ 1: A và B là 2 nguyên tố nằm cùng một nhóm và thuộc hai chu kỳ liên tiếp trong bảng tuần hoàn. Tổng số proton của 2 hạt nhân nguyên tử của A và B là 32. Hãy viết cấu hình electron của A, B và của các ion mà A và B có thể tạo thành.
Lời giải chi tiết:
Theo đề bài, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZB+ ZA = 32.
Trường hợp 1: ZB– ZA = 8. Ta có ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s2 2s2 2p6 3s2 ( thuộc chu kỳ 3, nhóm IIA).
và B: 1s2 2s2 2p6 3s2 3p6 4s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s2 2s2 2p6
và B2+: 1s2 2s2 2p6 3s2 3p6
Trường hợp 2: ZB– ZA = 18. Ta có ZA= 7; ZB= 25.
Cấu hình electron:
A : 1s2 2s2 2p3 (thuộc chu kỳ 2, nhóm VA).
và B: 1s2 2s2 2p6 3s2 3p5 4s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không nằm cùng nhóm nên không thỏa mãn.
Ví dụ 2: Cho 8,8g một hỗn hợp 2 kim loại nằm ở 2 chu kỳ liên tiếp nhau và thuộc nhóm IIIA, tác dụng với HCl dư thì thu được 6,72 lít khí hidro (đktc). Dựa vào bảng tuần hoàn các nguyên tố hóa học, hãy cho biết tên hai kim loại đó?
Lời giải chi tiết:
M là nguyên tử khối trung bình của 2 kim loại nhóm IIIA
Phương trình hóa học được biểu diễn: 2M + HCl → 2MCl2 + 3H2
nH2 = 6,72/22,4 = 0,3 (mol)
nM = 2/3 nH2 = 0,2 (mol)
Theo đề bài ra ta có: M.0,2 = 8,8 → M = 44
Hai kim loại này thuộc hai chu kỳ liên tiếp gồm một kim loại có nguyên tử khối nhỏ hơn 44 và một kim loại có nguyên tử khối lớn hơn 44.
Dựa vào bảng tuần hoàn hóa học, hai kim loại được xác định là : Ga (M = 69,72 > 44) và Al (M = 27
Ví dụ 3: Hòa tan 20,2g hỗn hợp 2 kim loại nằm ở 2 chu kỳ liên tiếp thuộc nhóm IA trong bảng tuần hoàn tác dụng với nước thu được dung dịch A và 6,72 L khí (đktc). Xác định tên và khối lượng của hai kim loại trong đề bài.
Lời giải chi tiết:
Gọi R là kí hiệu chung của hai kim loại thuộc nhóm IA và là nguyên tử khối trung bình của hai kim loại.
2 R + 2 H2O → 2 ROH + H2 ↑
0,6 0,3
nH2 = 6,72/22,4 = 0,3 (mol)
R = 20,2/0,6 = 33,67
Hai kim loại này thuộc hai chu kỳ liên tiếp do đó 1 kim loại phải có nguyên tử khối nhỏ hơn 33,67 và kim loại còn lại có nguyên tử khối lớn hơn 33,67.
Từ đó ta có: R1 = 23 (Na) 2 = 39 (K)
Dựa vào bảng tuần hoàn hóa học, 2 kim loại được xác định là Na, K.
2Na + 2H2O → 2NaOH + H2 ↑
x x/2
2K + 2H2O → 2KOH + H2 ↑
y y/2
Ta có hệ phương trình:
x + y = 0.6
23x + 39y = 20.2
Giải hệ phương trình ta có: x = 0.2 mol và y = 0.4 mol.
Vậy khối lượng từng kim loại là :
mNa = 23.0,2 = 4,6 (gam)
mK = 39.0,4 = 15,6 (gam)
6. Bài Tập Thực Hành Cách Xác Định Nhóm Nguyên Tố
Câu 1: Trong bảng tuần hoàn hóa học, các nguyên tố được sắp xếp theo nguyên tắc nào?
A. Theo chiều tăng dần của điện tích hạt nhân của các nguyên tố.
B. Các nguyên tố có số lớp electron trong nguyên tử bằng nhau được sắp xếp thành 1 hàng.
C. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được sắp xếp thành 1 cột.
D. Cả A, B, C
Câu 2: Chu kỳ là:
A. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
B. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều tăng dần số khối.
C. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
D. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều tăng dần số nơtron.
Câu 3: Nhóm nguyên tố là:
A. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron giống nhau, được xếp vào cùng một cột.
B. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hoá học tương tự nhau và được xếp thành một cột.
C. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hoá học gần giống nhau, được xếp thành một cột.
D. Tập hợp các nguyên tố thoả mãn nguyên tử có tính chất hoá học giống nhau và được xếp chung một cột.
Câu 4: Oxit cao nhất của một nguyên tố R chứa 38,8% nguyên tố đó, còn trong hợp chất khí với hidro chứa 2,74% hidro. Xác định nguyên tố R.
A. Cl B. Br C.Ba D. Al
Câu 5: Hợp chất của nguyên tố R với hiđro ở thể khí có dạng RH4. Oxit cao nhất của nguyên tố R có 53,3% khối lượng oxi. Số khối của nguyên tố R bằng bao nhiêu?
A. 12. B. 28. C. 32. D. 31.
Câu 6: Nguyên tử của nguyên tố nào dưới đây có xu hướng nhường 1 electron trong các phản ứng hóa học?
A. Na ở ô 11 thuộc bảng tuần hoàn.
B. Mg ở ô 12 thuộc bảng tuần hoàn.
C. Al ở ô 13 thuộc bảng tuần hoàn.
D. Si ở ô 14 thuộc bảng tuần hoàn.
Câu 7: Nguyên tố X có cấu hình electron là 1s2 2s2 2p3. Vậy vị trí X trong bảng tuần hoàn và công thức hợp chất với hiđro của X là :
A. Chu kỳ 2, nhóm VA, HXO3.
B. Chu kỳ 2, nhóm VA, XH4.
C. Chu kỳ 2, nhóm VA, XH3.
D. Chu kỳ 2, nhóm VA, XH2.
Câu 8: 2 nguyên tố X và Y nằm cùng 1 chu kỳ trong bảng tuần hoàn. Chúng có thể kết hợp với nhau tạo ion dạng XY3 2-, tổng số e trong ion này là 32. Kết luận nào dưới đây là sai?
A. Độ âm điện của X nhỏ hơn Y
B. X và Y là 2 nguyên tố phi kim
C. Công thức hóa học của hợp chất X với H là XH4
D. Y là phi kim mạnh nhất trong chu kỳ đó.
Câu 9: Cho các nguyên tố X, Y và Z với số hiệu nguyên tử lần lượt là 11, 29 và 37.
Phát biểu nào dưới đây đúng
A. Các nguyên tố này đều là kim loại thuộc nhóm IA
B. Các nguyên tố này không nằm cùng 1 chu kỳ
C. Thứ tự tính kim loại: X
D. Thứ tự tính bazơ: XOH
Câu 10: Các nguyên tố X, Y, Z và T lần lượt ở các ô nguyên tố 8, 11, 13 và 19 trong bảng tuần hoàn. Nhận xét nào dưới đây là đúng?
A. Các nguyên tố trên đều cùng thuộc 1 chu kỳ
B. Thứ tự tính kim loại X
C. Công thức hidroxit của nguyên tố Z là Z(OH)3
D. X là phi kim mạnh nhất trong chu kỳ 2
Câu 11: Nguyên tử X có bán kính rất lớn. Phát biểu nào sau đây là đúng về X?
A. X có độ âm điện rất lớn và X là phi kim
B. X có độ âm điện rất nhỏ và X là phi kim
C. X có độ âm điện rất lớn và X là kim loại
D. X có độ âm điện rất nhỏ và X là kim loại
Câu 12: X và Y là 2 nguyên tố thuộc 2 chu kỳ kế tiếp nhau trong cùng 1 nhóm A của bảng tuần hoàn. Biết X có điện tích hạt nhân nhỏ Y. Tổng số proton trong hạt nhân của 2 nguyên tử là 32. Nguyên tố X và Y là ?
A. Mg và Ca B. Na và K C. Cl và Br D, Mg và Al
Câu 13: Cho 6,08g hỗn hợp gồm 2 hidroxit của 2 kim loại kiềm (thuộc 2 chu kỳ kế tiếp nhau) tác dụng với 1 lượng HCl dư thu được 8,3g muối khan. Thành phần phần trăm khối lượng của hidroxit có phân tử khối nhỏ hơn là ?
A. 73,68% B. 52,63% C. 36,84% D. 26,32%
Câu 14: Trong 1 chu kỳ tính từ trái sang phải, theo chiều điện tích hạt nhân tăng dần thì:
A. Tính kim loại tăng dần, tính phi kim giảm dần
B. Tính kim loại giảm dần, tính phi kim tăng dần
C. Tính kim loại và tính phi kim đều tăng dần
D. Tính kim loại và tính phi kim đều giảm dần
Câu 15: Cho 2 nguyên tố X, Y thuộc cùng 1 nhóm và nằm 2 chu kỳ liên tiếp, tổng số điện tích hạt nhân của X và Y là 58. Biết Zx
a. Mn B. As C. Al D. Ca
Câu 16: Sắp xếp các nguyên tố sau theo chiều điện tích hạt nhân giảm dần: S, Te, O, Se
A. O – Se – Te – S. B. Te – Se – S –O
C. O – S – Se – Te. D. O – Se – S – Te.
Câu 17: Công thức của hợp chất khí của X với hidro là XH2. Vậy công thức oxit hóa trị cao nhất của X với oxi là :
A. X2O7 B. XO3 C. X2O3 D. XO
Câu 18: Dãy các nguyên tố nào dưới đây được xếp theo chiều tăng dần tính kim loại?
A. Li, Be, Na, K
B. Al, Mg, Na, Li
C. Mg, K, Rb, Cs
D. Mg, Na, Rb, Sr
Câu 19: Một nguyên tố R có cấu hình electron: 1s2 2s2 2p6 3s2 3p4 , công thức hợp chất của R với hiđro và công thức oxit cao nhất là :
A. RH2, RO. B. RH2, RO3. C. RH2, RO2. D. RH5, R2O5.
Câu 20: X là nguyên tố p. Tổng số hạt trong nguyên tử X là 40. Vậy vị trí của X trong bảng tuần hoàn là
A. Ô 41, chu kỳ 5, nhóm IVB. B. Ô 14, chu kỳ 3, nhóm IIA.
C. Ô 13, chu kỳ 3, nhóm IIIA. D. Ô 15, chu kỳ 3, nhóm VA.
Đáp án tham khảo:
| 1. D | 2. C | 3. C | 4. A | 5. B | 6. A | 7. C | 8. D | 9. B | 10. C |
|---|---|---|---|---|---|---|---|---|---|
| 11. D | 12. A | 13. D | 14. B | 15. D | 16. C | 17. B | 18. C | 19. B | 20. C |
7. FAQ – Câu Hỏi Thường Gặp
1. Nhóm B còn được gọi là gì?
Nhóm B còn được gọi là nhóm các kim loại chuyển tiếp.
2. Các nguyên tố nhóm B có những tính chất chung nào?
Đa số là kim loại, có nhiều hóa trị, hợp chất có màu, hoạt tính xúc tác cao.
3. Tại sao các nguyên tố nhóm B lại có nhiều hóa trị?
Do có sự tham gia của các electron ở lớp d vào liên kết hóa học.
4. Ứng dụng quan trọng nhất của các nguyên tố nhóm B là gì?
Sắt (Fe) là thành phần chính của thép, được sử dụng rộng rãi trong xây dựng và công nghiệp.
5. Có bao nhiêu nhóm B trong bảng tuần hoàn?
Có 8 nhóm B, được đánh số từ IIIB đến VIIIB và từ IB đến IIB.
6. Hai hàng cuối của bảng tuần hoàn thuộc khối nào?
Thuộc khối f, bao gồm họ Lanthan và họ Actini.
7. Nguyên tố nào trong nhóm B được sử dụng trong y học để điều trị ung thư?
Platin (Pt).
8. Nguyên tố nào trong nhóm B được sử dụng làm vật liệu dẫn điện chính?
Đồng (Cu).
9. Nhóm B có bao gồm các nguyên tố phi kim không?
Không, nhóm B chủ yếu bao gồm các kim loại.
10. Làm thế nào để xác định một nguyên tố có thuộc nhóm B hay không?
Dựa vào cấu hình electron và vị trí của nó trong bảng tuần hoàn (khối d hoặc khối f).
Kết Luận
Hy vọng bài viết này của CAUHOI2025.EDU.VN đã giúp bạn hiểu rõ hơn về “nhóm B bao gồm các nguyên tố” nào và những đặc điểm quan trọng của chúng. Với kiến thức này, bạn sẽ tự tin hơn khi học tập và làm việc liên quan đến hóa học.
Nếu bạn còn bất kỳ thắc mắc nào hoặc muốn tìm hiểu sâu hơn về các chủ đề hóa học khác, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để khám phá thêm nhiều kiến thức bổ ích. Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng giải đáp mọi câu hỏi và cung cấp cho bạn những thông tin chính xác, đáng tin cậy nhất.
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CAUHOI2025.EDU.VN
Hãy để CauHoi2025.EDU.VN trở thành người bạn đồng hành trên con đường chinh phục kiến thức hóa học của bạn!



