Nguyên Tử và Phân Tử Là Gì? Khám Phá Cấu Tạo và Đặc Tính
Bạn đang tìm hiểu về Nguyên Tử Và Phân Tử? CAUHOI2025.EDU.VN sẽ giúp bạn khám phá cấu tạo, đặc tính và sự khác biệt giữa nguyên tử và phân tử một cách chi tiết và dễ hiểu nhất.
Giới thiệu
Thế giới xung quanh ta được tạo nên từ vô vàn các chất khác nhau. Nhưng bạn có bao giờ tự hỏi, điều gì tạo nên những chất đó? Câu trả lời nằm ở nguyên tử và phân tử – những viên gạch cơ bản của vật chất. Bài viết này sẽ cung cấp cho bạn cái nhìn toàn diện về nguyên tử và phân tử, từ cấu tạo, đặc tính đến vai trò của chúng trong thế giới tự nhiên.
1. Lịch Sử Nghiên Cứu Về Nguyên Tử
Khái niệm về nguyên tử đã xuất hiện từ rất lâu đời.
1.1. Thời Kỳ Cổ Đại Hy Lạp
Ý tưởng về những hạt nhỏ bé, không thể phân chia được (atomos trong tiếng Hy Lạp cổ đại) đã được các nhà triết học Hy Lạp như Democritus và Leucippus đưa ra từ thế kỷ thứ 5 trước Công nguyên. Tuy nhiên, đây chỉ là những suy đoán triết học, không dựa trên bằng chứng thực nghiệm.
1.2. Thế Kỷ 18 và 19: Sự Phát Triển Của Lý Thuyết Nguyên Tử Hiện Đại
Những nghiên cứu khoa học thực nghiệm đã bắt đầu hình thành nên lý thuyết nguyên tử hiện đại.
- John Dalton (1803-1808): Nhà hóa học, vật lý học và nhà khí tượng học người Anh, được coi là cha đẻ của lý thuyết nguyên tử hiện đại. Dalton đưa ra các tiên đề quan trọng:
- Mọi vật chất được cấu tạo từ các nguyên tử không thể phân chia và không thể phá hủy.
- Các nguyên tử của một nguyên tố nhất định giống nhau về mọi mặt, đặc biệt là khối lượng.
- Các nguyên tử của các nguyên tố khác nhau có khối lượng khác nhau.
- Các hợp chất hóa học được tạo thành khi các nguyên tử của các nguyên tố khác nhau kết hợp với nhau theo tỷ lệ số nguyên đơn giản.
- Robert Brown (1827): Nhà thực vật học người Scotland, quan sát thấy các hạt phấn hoa chuyển động hỗn loạn trong nước dưới kính hiển vi. Hiện tượng này, sau này được gọi là chuyển động Brown, là một bằng chứng gián tiếp về sự tồn tại của các nguyên tử và phân tử.
- Johann Josef Loschmidt (1865): Nhà khoa học người Áo, người đầu tiên ước tính kích thước của phân tử trong không khí. Số Loschmidt, một hằng số quan trọng trong hóa học, được đặt theo tên ông.
- Albert Einstein (1905): Nhà vật lý vĩ đại người Đức, giải thích chuyển động Brown bằng lý thuyết động học phân tử, cung cấp bằng chứng thuyết phục về sự tồn tại của các nguyên tử và phân tử.
1.3. Đầu Thế Kỷ 20: Khám Phá Cấu Trúc Bên Trong Nguyên Tử
Những khám phá quan trọng đã làm thay đổi hiểu biết của chúng ta về cấu trúc nguyên tử:
- J.J. Thomson (1897): Phát hiện ra electron, chứng minh rằng nguyên tử không phải là hạt không thể phân chia như Dalton đã nghĩ. Thomson đề xuất mô hình “bánh pudding mận” cho nguyên tử, trong đó các electron âm được nhúng trong một khối tích điện dương.
- Ernest Rutherford (1911): Thực hiện thí nghiệm tán xạ hạt alpha, chứng minh rằng hầu hết khối lượng của nguyên tử tập trung ở một hạt nhân nhỏ, tích điện dương. Rutherford đề xuất mô hình hành tinh nguyên tử, trong đó các electron quay quanh hạt nhân giống như các hành tinh quay quanh Mặt Trời.
- Niels Bohr (1913): Phát triển mô hình Bohr cho nguyên tử hydro, kết hợp lý thuyết lượng tử của Max Planck để giải thích sự ổn định của nguyên tử và quang phổ phát xạ của hydro.
2. Khái Niệm Nguyên Tử
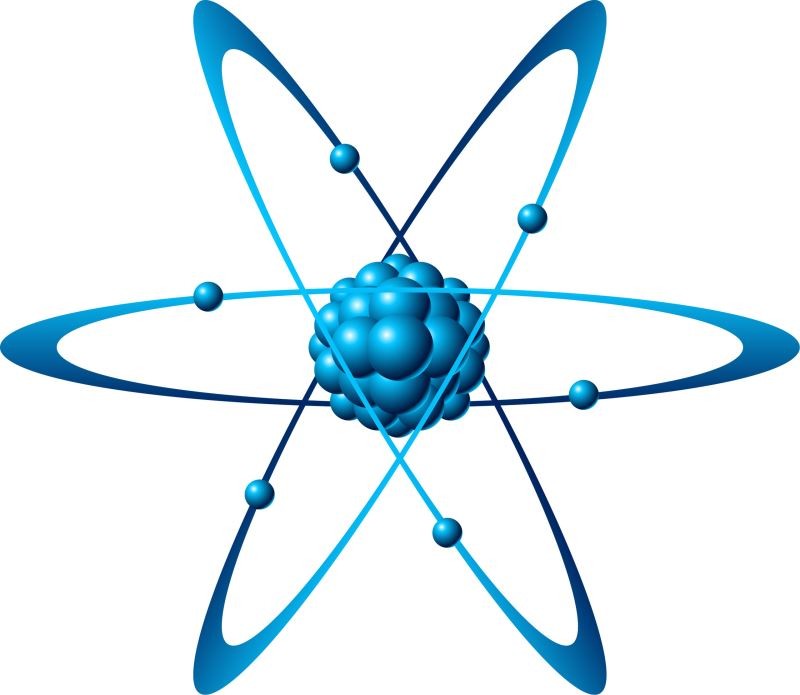
Nguyên tử là đơn vị cơ bản của vật chất, bao gồm một hạt nhân trung tâm chứa proton (điện tích dương) và neutron (không điện tích), xung quanh là các electron (điện tích âm) chuyển động trên các quỹ đạo xác định. Theo sách giáo khoa Hóa học 8 của Nhà xuất bản Giáo dục Việt Nam, nguyên tử là hạt vô cùng nhỏ và trung hòa về điện, cấu tạo từ hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm.

2.1. Cấu Tạo Của Nguyên Tử
- Hạt nhân: Chứa proton và neutron. Số proton trong hạt nhân quyết định nguyên tố hóa học của nguyên tử.
- Electron: Chuyển động xung quanh hạt nhân trên các quỹ đạo (lớp) khác nhau. Số electron bằng số proton trong nguyên tử trung hòa về điện.
2.2. Các Khái Niệm Liên Quan
2.2.1. Hạt Nhân Nguyên Tử
Hạt nhân nguyên tử nằm ở trung tâm nguyên tử, cấu tạo từ proton và neutron. Số proton trong hạt nhân xác định nguyên tố hóa học. Ví dụ, tất cả các nguyên tử có 6 proton đều là nguyên tử carbon.
2.2.2. Lớp Electron Trong Nguyên Tử
Electron không chuyển động hỗn loạn xung quanh hạt nhân mà sắp xếp thành từng lớp, mỗi lớp có số lượng electron tối đa nhất định. Các electron lớp ngoài cùng (electron hóa trị) quyết định tính chất hóa học của nguyên tử.
2.2.3. Số Nguyên Tử
Số nguyên tử (Z) là số proton trong hạt nhân của một nguyên tử. Số nguyên tử là duy nhất cho mỗi nguyên tố và được sử dụng để xác định vị trí của nguyên tố đó trong bảng tuần hoàn.
2.2.4. Nguyên Tử Khối
Nguyên tử khối (hay khối lượng nguyên tử) là khối lượng trung bình của một nguyên tử, tính bằng đơn vị khối lượng nguyên tử (amu). Theo sách giáo khoa Hóa học 8, Nhà xuất bản Giáo dục Việt Nam, nguyên tử khối là khối lượng của một nguyên tử tính bằng đơn vị cacbon.
2.2.5. Đồng Vị
Đồng vị là các nguyên tử của cùng một nguyên tố (có cùng số proton) nhưng có số neutron khác nhau, do đó có nguyên tử khối khác nhau.
3. Khái Niệm Phân Tử
Phân tử là một nhóm gồm hai hoặc nhiều nguyên tử liên kết với nhau bằng liên kết hóa học. Phân tử là đơn vị nhỏ nhất của một hợp chất có thể tồn tại độc lập và giữ lại các tính chất hóa học của hợp chất đó.
3.1. Cấu Tạo Của Phân Tử
Phân tử được tạo thành từ hai hoặc nhiều nguyên tử liên kết với nhau bằng liên kết hóa học. Các liên kết hóa học có thể là liên kết cộng hóa trị (chia sẻ electron) hoặc liên kết ion (chuyển electron).
3.2. Các Loại Phân Tử
- Phân tử đơn chất: Được tạo thành từ các nguyên tử của cùng một nguyên tố (ví dụ: O2, N2).
- Phân tử hợp chất: Được tạo thành từ các nguyên tử của các nguyên tố khác nhau (ví dụ: H2O, CO2).
4. Phân Biệt Nguyên Tử Và Phân Tử
Nhiều người thường nhầm lẫn giữa nguyên tử và phân tử. Dưới đây là bảng so sánh chi tiết để giúp bạn phân biệt hai khái niệm này:
| Đặc Điểm So Sánh | Nguyên Tử | Phân Tử |
|---|---|---|
| Khái Niệm | Là hạt vô cùng nhỏ, trung hòa về điện. Gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm. | Là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất. |
| Ví Dụ | Nguyên tử oxy, nguyên tử cacbon | Oxy (O2), nước (H2O) |
| Hình Dạng | Hình cầu | Nhiều hình dáng |
| Tính Chất | Không thể phân đôi nguyên tử | Các nguyên tố trong phân tử có thể tách rời và kết hợp với nhau. |
| Sự Tồn Tại | Có thể tồn tại hoặc không tồn tại ở trạng thái tự do | Tồn tại trong trạng thái tự do |
| Tầm Nhìn | Không nhìn thấy bằng mắt thường | Không thể nhìn thấy bằng mắt thường nhưng nếu có kính hiển vi vẫn có thể quan sát |
| Khả Năng Phản Ứng | Phản ứng cao, có ngoại lệ nhất định | Ít phản ứng |
| Liên Kết | Liên kết hạt nhân | Liên kết cộng hóa trị hoặc liên kết ion |
Alt: Bảng so sánh chi tiết các đặc điểm khác biệt giữa nguyên tử và phân tử.
5. Ứng Dụng Của Nguyên Tử Và Phân Tử
Hiểu biết về nguyên tử và phân tử có ứng dụng vô cùng rộng rãi trong nhiều lĩnh vực khoa học và công nghệ:
- Hóa học: Nghiên cứu cấu trúc, tính chất và phản ứng của các chất dựa trên cấu tạo nguyên tử và phân tử.
- Vật lý: Nghiên cứu cấu trúc và tính chất của vật chất ở cấp độ nguyên tử và phân tử.
- Sinh học: Nghiên cứu cấu trúc và chức năng của các phân tử sinh học như protein, DNA, carbohydrate và lipid.
- Y học: Phát triển các loại thuốc và phương pháp điều trị bệnh dựa trên hiểu biết về tương tác giữa các phân tử trong cơ thể.
- Công nghệ vật liệu: Thiết kế và chế tạo các vật liệu mới với các tính chất đặc biệt dựa trên cấu trúc nguyên tử và phân tử.
6. Bài Tập Củng Cố Kiến Thức
6.1. Bài 1: Ôn Tập Khái Niệm Nguyên Tử
“(1) là hạt vô cùng nhỏ, trung hòa về điện: từ (2) tạo ra mọi chất. Nguyên tử gồm (3) mang điện tích dương và vỏ tạo bởi (4)”.
Gợi ý đáp án:
(1): Nguyên tử
(2): nguyên tử
(3) hạt nhân
(4) một hay nhiều electron mang điện tích âm
6.2. Bài 2: Bài Tập Ôn Tập SGK Hóa Học 8 Trang 25
Kim loại đồng, sắt được tạo nên từ nguyên tố nào? Nêu sự sắp xếp nguyên tử trong đơn chất kim loại.
Gợi ý đáp án:
Kim loại đồng được tạo nên từ nguyên tố Cu; kim loại sắt được tạo nên từ nguyên tố Fe;
Sự sắp xếp nguyên tử trong đơn chất kim loại: Chúng được sắp xếp khít nhau và theo một trật tự xác định.
7. Câu Hỏi Thường Gặp (FAQ)
- Nguyên tử có thể nhìn thấy bằng mắt thường không?
Không, nguyên tử có kích thước vô cùng nhỏ, không thể nhìn thấy bằng mắt thường. - Phân tử lớn nhất là gì?
Các phân tử sinh học như DNA và protein có thể có kích thước rất lớn, chứa hàng triệu nguyên tử. - Tại sao hiểu biết về nguyên tử và phân tử lại quan trọng?
Hiểu biết về nguyên tử và phân tử là nền tảng của nhiều lĩnh vực khoa học và công nghệ, giúp chúng ta giải thích và kiểm soát thế giới xung quanh. - Nguyên tử có thể bị phá hủy không?
Trong các phản ứng hóa học thông thường, nguyên tử không bị phá hủy mà chỉ sắp xếp lại để tạo thành các phân tử mới. Tuy nhiên, trong các phản ứng hạt nhân, nguyên tử có thể bị biến đổi thành các nguyên tố khác. - Phân tử nước (H2O) được tạo thành từ những nguyên tử nào?
Phân tử nước được tạo thành từ hai nguyên tử hydro (H) và một nguyên tử oxy (O). - Liên kết hóa học nào giữ các nguyên tử trong phân tử lại với nhau?
Các nguyên tử trong phân tử được giữ lại với nhau bằng liên kết hóa học, có thể là liên kết cộng hóa trị hoặc liên kết ion. - Số proton trong hạt nhân của một nguyên tử có ý nghĩa gì?
Số proton trong hạt nhân xác định nguyên tố hóa học của nguyên tử. - Electron di chuyển như thế nào xung quanh hạt nhân của một nguyên tử?
Electron di chuyển xung quanh hạt nhân trên các quỹ đạo (lớp) khác nhau. - Sự khác biệt giữa phân tử đơn chất và phân tử hợp chất là gì?
Phân tử đơn chất được tạo thành từ các nguyên tử của cùng một nguyên tố, trong khi phân tử hợp chất được tạo thành từ các nguyên tử của các nguyên tố khác nhau. - Nguyên tử khối là gì và nó được đo bằng đơn vị nào?
Nguyên tử khối là khối lượng trung bình của một nguyên tử, tính bằng đơn vị khối lượng nguyên tử (amu).
Kết luận
Nguyên tử và phân tử là những khái niệm cơ bản nhưng vô cùng quan trọng để hiểu về thế giới vật chất xung quanh chúng ta. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức hữu ích và thú vị về chủ đề này.
Nếu bạn còn bất kỳ thắc mắc nào, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để khám phá thêm nhiều câu trả lời và đặt câu hỏi của riêng bạn. Chúng tôi luôn sẵn sàng cung cấp thông tin chính xác, đáng tin cậy và dễ hiểu cho bạn. Hãy liên hệ với chúng tôi tại địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc qua số điện thoại +84 2435162967. Bạn cũng có thể tìm hiểu thêm về chúng tôi tại trang “Liên hệ” trên website CauHoi2025.EDU.VN.