Ký Hiệu Enthalpy Tạo Thành (Nhiệt Tạo Thành) Của Phản Ứng Chuẩn Là Gì?
Bạn đang tìm hiểu về ký hiệu enthalpy tạo thành chuẩn của phản ứng? Bài viết này từ CAUHOI2025.EDU.VN sẽ giải đáp chi tiết, giúp bạn nắm vững kiến thức về nhiệt động lực học và ứng dụng vào học tập, nghiên cứu. Khám phá ngay để hiểu rõ hơn về biến thiên enthalpy và các yếu tố ảnh hưởng đến phản ứng hóa học!
1. Phản Ứng Tỏa Nhiệt và Thu Nhiệt: Khái Niệm Cơ Bản
1.1. Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là quá trình hóa học giải phóng năng lượng dưới dạng nhiệt, ánh sáng hoặc âm thanh. Đặc điểm của phản ứng tỏa nhiệt là có thể xảy ra tự phát và làm tăng tính ngẫu nhiên (entropy) của hệ (S > 0). Về mặt nhiệt động học, phản ứng tỏa nhiệt được biểu thị bằng dòng nhiệt âm (nhiệt bị mất ra môi trường) và sự giảm enthalpy (ΔH < 0).
1.2. Phản Ứng Thu Nhiệt Là Gì?
Ngược lại với phản ứng tỏa nhiệt, phản ứng thu nhiệt là quá trình hóa học hấp thụ năng lượng từ môi trường để xảy ra. Phản ứng thu nhiệt không thể tự phát mà cần cung cấp năng lượng từ bên ngoài. Trong quá trình phản ứng, nhiệt độ sẽ giảm do năng lượng bị hấp thụ. Phản ứng thu nhiệt được đặc trưng bởi dòng nhiệt dương (nhiệt đi vào hệ phản ứng) và sự tăng enthalpy (+ΔH).
Ví dụ điển hình của phản ứng thu nhiệt là quá trình nung đá vôi:
CaCO3 (r) → CaO (r) + CO2 (k)
Nếu ngừng cung cấp nhiệt, phản ứng sẽ dừng lại.

2. Biến Thiên Enthalpy Chuẩn của Phản Ứng
2.1. Định Nghĩa Biến Thiên Enthalpy
Biến thiên enthalpy của phản ứng (hay còn gọi là nhiệt phản ứng) được ký hiệu là ΔH và thường được tính theo đơn vị kJ hoặc kcal. Theo định nghĩa, biến thiên enthalpy của phản ứng là lượng nhiệt tỏa ra hoặc thu vào của một phản ứng hóa học trong quá trình đẳng áp (điều kiện áp suất không đổi).
Biến thiên enthalpy chuẩn (hay còn gọi là nhiệt phản ứng chuẩn) của một phản ứng hóa học, được ký hiệu là ΔrHo298, là lượng nhiệt kèm theo phản ứng đó trong điều kiện chuẩn. Điều kiện chuẩn được quy định là áp suất 1 bar đối với chất khí, nồng độ 1 mol/L đối với chất tan trong dung dịch và nhiệt độ thường là 25 độ C (tương đương với 298 độ K).
2.2. Phương Trình Nhiệt Hóa Học
Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ, hay còn gọi là chất tham gia) và chất sản phẩm (sp).
- Phản ứng thu nhiệt (hệ nhận nhiệt từ môi trường) có ΔrHo298 > 0.
- Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) có ΔrHo298 < 0.
Ví dụ:
C(r) + H2O (k) → CO (k) + H2 (k) ; ΔrHo298 = +131.25kJ > 0
=> Phản ứng trên là phản ứng thu nhiệt.
CuSO4 (dd) + Zn (r) → ZnSO4 (dd) + Cu (r) ; ΔrHo298 = -231.04 kJ
=> Phản ứng trên là phản ứng tỏa nhiệt.
2.3. Enthalpy Tạo Thành (Nhiệt Tạo Thành)
Ký Hiệu Enthalpy Tạo Thành (nhiệt Tạo Thành) Của Phản ứng ở điều Kiện Chuẩn Là ΔfHo298. Đây là lượng nhiệt tỏa ra hoặc thu vào khi tạo thành 1 mol một chất từ các đơn chất bền nhất ở điều kiện chuẩn.
Enthalpy tạo thành chuẩn của một chất là lượng nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn. Đơn vị thường dùng là kJ/mol hoặc kcal/mol.
Ví dụ: ΔfHo298 (CO2, k) = -393.50 kJ/mol là lượng nhiệt được tỏa ra môi trường khi tạo ra 1 mol CO2 (k) từ các đơn chất ở trạng thái bền trong điều kiện chuẩn (carbon dạng graphite, oxygen dạng phân tử khí là các dạng đơn chất bền nhất của C và O).
C (graphite) + O2 (k) → CO2 (k) ; ΔfHo298 (CO2, k) = -393.50 kJ/mol
Lưu ý:
- ΔfHo298 của đơn chất bền nhất = 0 (xét ở điều kiện chuẩn).
- ΔfHo298 < 0: chất bền hơn về mặt năng lượng so với các đơn chất bền tạo thành nó.
- ΔfHo298 > 0: chất kém bền hơn về mặt năng lượng so với các đơn chất bền tạo thành nó.

3. So Sánh Phản Ứng Tỏa Nhiệt và Thu Nhiệt
Để hiểu rõ hơn về sự khác biệt giữa phản ứng tỏa nhiệt và thu nhiệt, chúng ta có thể so sánh chúng dựa trên các tiêu chí sau:
| Cơ sở so sánh | Phản ứng thu nhiệt | Phản ứng tỏa nhiệt |
|---|---|---|
| Ý nghĩa | Phản ứng hóa học liên quan đến việc sử dụng năng lượng từ môi trường để hình thành liên kết hóa học mới. | Phản ứng hóa học trong đó năng lượng được giải phóng ra ngoài môi trường dưới dạng nhiệt. |
| Năng lượng | Đòi hỏi hấp thụ năng lượng từ môi trường dưới dạng nhiệt. | Giải phóng năng lượng dưới dạng nhiệt ra ngoài môi trường. |
| Enthalpy (ΔH) | ΔH dương (> 0), vì nhiệt được hấp thụ. | ΔH âm (< 0), vì nhiệt được giải phóng. |
| Ví dụ | 1. Băng chuyển đổi thành hơi nước thông qua đun sôi, tan chảy hoặc bay hơi. 2. Phá vỡ các phân tử khí. 3. Sản xuất muối khan từ hydrat. |
1. Hình thành băng từ nước. 2. Đốt than (đốt cháy). 3. Phản ứng giữa nước và axit mạnh. |
| Ứng dụng thực tế | Sản xuất một số hóa chất đặc biệt, làm lạnh (ví dụ: túi chườm lạnh). | Phát điện (đốt nhiên liệu), sưởi ấm, nấu nướng, sản xuất nhiều loại hóa chất công nghiệp. |
| Ảnh hưởng nhiệt độ | Làm giảm nhiệt độ của môi trường xung quanh. | Làm tăng nhiệt độ của môi trường xung quanh. |
| Tính tự diễn ra | Không tự diễn ra ở điều kiện thường, cần cung cấp năng lượng liên tục. | Có thể tự diễn ra sau khi bắt đầu, hoặc cần một lượng nhỏ năng lượng kích hoạt ban đầu. |
| Thay đổi Entropy (ΔS) | Thường làm giảm entropy (ΔS < 0) do hệ trở nên có trật tự hơn khi liên kết hình thành. | Thường làm tăng entropy (ΔS > 0) do hệ trở nên hỗn loạn hơn khi các liên kết bị phá vỡ và các phân tử được giải phóng. |
| Áp suất | Áp suất có thể ảnh hưởng đến tốc độ và hiệu suất của phản ứng, đặc biệt nếu có sự thay đổi về số mol khí. | Áp suất có thể ảnh hưởng đến tốc độ và hiệu suất của phản ứng, đặc biệt nếu có sự thay đổi về số mol khí. |
| Chất xúc tác | Chất xúc tác có thể làm giảm năng lượng hoạt hóa cần thiết để bắt đầu phản ứng, nhưng không làm thay đổi bản chất thu nhiệt của nó. | Chất xúc tác có thể làm giảm năng lượng hoạt hóa cần thiết để bắt đầu phản ứng, nhưng không làm thay đổi bản chất tỏa nhiệt của nó. |
| Ví dụ minh họa | Phản ứng phân hủy muối amoni nitrat (NH4NO3) khi hòa tan trong nước. | Phản ứng trung hòa giữa axit và bazơ. |
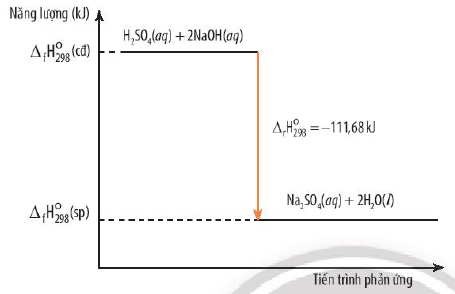
4. Ý Nghĩa Của Dấu và Giá Trị ΔH°298
-
Phản ứng tỏa nhiệt: ∑ΔfHo298(sp) < ∑ΔfHo298(cđ) => ΔrHo298 < 0
Ví dụ: H2SO4 (dd) + 2NaOH (dd) → Na2SO4 (dd) + 2 H2O (l) ; ΔrHo298 = -111.68 kJ
-
Phản ứng thu nhiệt: ∑ΔfHo298(sp) > ∑ΔfHo298(cđ) => ΔrHo298 > 0
Ví dụ: phản ứng nhiệt phân CaCO3 : CaCO3 (r) → CaO (r) + CO2 (k) ; ΔrHo298 = +178.49 kJ
Đối với các phản ứng có ΔrHo298 < 0 thường xảy ra thuận lợi.
Đối với các phản ứng thu nhiệt, nhiệt cần được cung cấp liên tục, nếu dừng cung cấp nhiệt, phản ứng sẽ không thể tiếp tục xảy ra.

5. Ứng Dụng của Enthalpy Trong Thực Tế
Hiểu rõ về enthalpy và các phản ứng tỏa nhiệt, thu nhiệt có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất năng lượng: Các nhà máy nhiệt điện đốt than, dầu, khí đốt (phản ứng tỏa nhiệt) để tạo ra nhiệt năng, sau đó chuyển thành điện năng.
- Sưởi ấm và làm mát: Sử dụng các phản ứng tỏa nhiệt để sưởi ấm (ví dụ: đốt củi, than) và các phản ứng thu nhiệt để làm mát (ví dụ: tủ lạnh, máy điều hòa).
- Nấu ăn: Các phản ứng đốt cháy gas, củi, than để cung cấp nhiệt cho việc nấu nướng.
- Sản xuất hóa chất: Nhiều quy trình sản xuất hóa chất dựa trên các phản ứng tỏa nhiệt hoặc thu nhiệt. Việc kiểm soát nhiệt độ là yếu tố quan trọng để đảm bảo hiệu suất và an toàn của quá trình.
- Nghiên cứu khoa học: Enthalpy là một thông số quan trọng trong nghiên cứu nhiệt động lực học, giúp các nhà khoa học hiểu rõ hơn về bản chất của các phản ứng hóa học và dự đoán khả năng xảy ra của chúng.
6. Câu Hỏi Thường Gặp (FAQ)
1. Enthalpy là gì?
Enthalpy là một hàm trạng thái nhiệt động học, biểu thị tổng năng lượng bên trong của một hệ thống cộng với tích của áp suất và thể tích của nó.
2. Biến thiên enthalpy (ΔH) là gì?
Biến thiên enthalpy (ΔH) là sự thay đổi enthalpy của một hệ thống trong một quá trình, thường là một phản ứng hóa học. Nó cho biết lượng nhiệt được hấp thụ hoặc giải phóng trong quá trình đó ở áp suất không đổi.
3. Ký hiệu ΔfHo298 có nghĩa là gì?
ΔfHo298 là ký hiệu của enthalpy tạo thành chuẩn của một chất ở 298 K (25°C) và áp suất 1 bar.
4. Phản ứng tỏa nhiệt có ΔH như thế nào?
Phản ứng tỏa nhiệt có ΔH < 0 (âm).
5. Phản ứng thu nhiệt có ΔH như thế nào?
Phản ứng thu nhiệt có ΔH > 0 (dương).
6. Enthalpy tạo thành chuẩn của một đơn chất bền là bao nhiêu?
Enthalpy tạo thành chuẩn của một đơn chất bền ở điều kiện chuẩn là 0.
7. Làm thế nào để tính biến thiên enthalpy của một phản ứng?
Biến thiên enthalpy của một phản ứng có thể được tính bằng cách sử dụng công thức: ΔH = ∑ΔfH(sản phẩm) – ∑ΔfH(chất phản ứng).
8. Tại sao cần phải biết về enthalpy của các phản ứng?
Hiểu biết về enthalpy giúp dự đoán khả năng xảy ra của một phản ứng, tính toán lượng nhiệt cần thiết hoặc giải phóng trong một quá trình, và tối ưu hóa các quy trình công nghiệp.
9. Yếu tố nào ảnh hưởng đến enthalpy?
Các yếu tố ảnh hưởng đến enthalpy bao gồm: nhiệt độ, áp suất, trạng thái vật lý của chất, và thành phần hóa học của hệ thống.
10. Làm thế nào để đo enthalpy?
Enthalpy có thể được đo bằng phương pháp đo nhiệt lượng (calorimetry) sử dụng một thiết bị gọi là calorimeter.
CAUHOI2025.EDU.VN hy vọng bài viết này đã giúp bạn hiểu rõ về ký hiệu enthalpy tạo thành (nhiệt tạo thành) của phản ứng ở điều kiện chuẩn và các khái niệm liên quan. Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại truy cập CauHoi2025.EDU.VN để tìm kiếm câu trả lời hoặc liên hệ với chúng tôi theo địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc số điện thoại +84 2435162967 để được tư vấn chi tiết hơn.



