KMnO4 Tác Dụng Với SO2: Giải Thích Chi Tiết Và Ứng Dụng Thực Tế
Bạn đang thắc mắc về phản ứng giữa KMnO4 và SO2? Bài viết này từ CAUHOI2025.EDU.VN sẽ cung cấp thông tin chi tiết, dễ hiểu về phản ứng oxy hóa khử này, cùng các ứng dụng quan trọng của nó trong thực tế, giúp bạn nắm vững kiến thức và giải quyết các bài tập liên quan.
1. Phản Ứng Giữa KMnO4 và SO2 Là Gì?
Phản ứng giữa kali pemanganat (KMnO4) và lưu huỳnh đioxit (SO2) là một phản ứng oxy hóa khử mạnh mẽ, trong đó KMnO4 đóng vai trò là chất oxy hóa và SO2 là chất khử. Phản ứng này thường được thực hiện trong môi trường axit hoặc trung tính.
Phương trình hóa học tổng quát của phản ứng như sau:
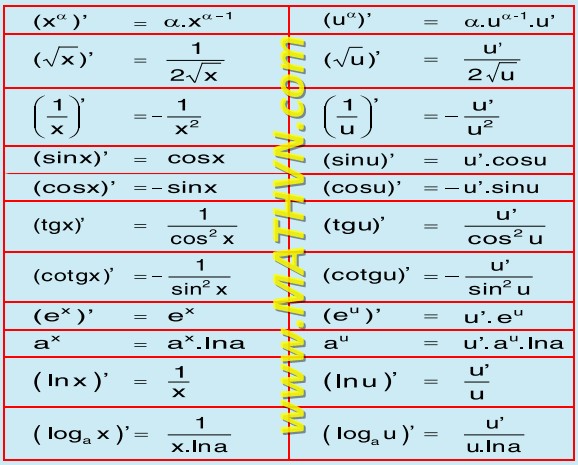
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
Trong phản ứng này:
- KMnO4 (kali pemanganat) bị khử thành MnSO4 (mangan(II) sunfat). Số oxy hóa của Mn giảm từ +7 trong KMnO4 xuống +2 trong MnSO4.
- SO2 (lưu huỳnh đioxit) bị oxy hóa thành H2SO4 (axit sunfuric). Số oxy hóa của S tăng từ +4 trong SO2 lên +6 trong H2SO4.
- Nước (H2O) tham gia vào phản ứng để cung cấp môi trường cho các ion.
2. Điều Kiện Để Phản Ứng KMnO4 và SO2 Xảy Ra
Để phản ứng giữa KMnO4 và SO2 xảy ra hiệu quả, cần có các điều kiện sau:
- Môi trường phản ứng: Phản ứng xảy ra tốt nhất trong môi trường axit hoặc trung tính. Trong môi trường kiềm, phản ứng có thể diễn ra theo hướng khác hoặc chậm hơn.
- Nồng độ chất phản ứng: Nồng độ của KMnO4 và SO2 ảnh hưởng đến tốc độ phản ứng. Nồng độ càng cao, tốc độ phản ứng càng nhanh.
- Nhiệt độ: Nhiệt độ cao có thể làm tăng tốc độ phản ứng, nhưng cũng có thể gây ra các phản ứng phụ không mong muốn.
3. Cơ Chế Phản Ứng KMnO4 và SO2
Phản ứng giữa KMnO4 và SO2 diễn ra qua nhiều giai đoạn, trong đó các electron được chuyển từ SO2 sang KMnO4. Cơ chế phản ứng có thể được mô tả như sau:
-
SO2 hòa tan trong nước: SO2 hòa tan trong nước tạo thành axit sunfurơ (H2SO3):
SO2 + H2O ⇌ H2SO3
-
H2SO3 phân ly: Axit sunfurơ phân ly thành các ion:
H2SO3 ⇌ H+ + HSO3-
-
KMnO4 phân ly: KMnO4 phân ly trong nước tạo thành các ion:
KMnO4 → K+ + MnO4-
-
Phản ứng oxy hóa khử: Ion pemanganat (MnO4-) oxy hóa ion bisulfit (HSO3-) thành ion sunfat (SO42-):
2MnO4- + 5HSO3- + H+ → 2Mn2+ + 5SO42- + 3H2O
Phản ứng này diễn ra nhanh chóng và làm mất màu tím đặc trưng của dung dịch KMnO4.
4. Dấu Hiệu Nhận Biết Phản Ứng KMnO4 và SO2
Dấu hiệu rõ ràng nhất để nhận biết phản ứng giữa KMnO4 và SO2 là sự mất màu tím của dung dịch KMnO4. Ban đầu, dung dịch KMnO4 có màu tím đậm. Khi SO2 được thêm vào, màu tím này sẽ nhạt dần và cuối cùng biến mất hoàn toàn, tạo thành dung dịch không màu hoặc có màu hồng nhạt của ion Mn2+.
Alt text: Dung dịch kali pemanganat (KMnO4) mất màu tím khi phản ứng với khí lưu huỳnh đioxit (SO2), tạo thành dung dịch không màu chứa mangan sunfat (MnSO4).
5. Ứng Dụng Của Phản Ứng KMnO4 và SO2
Phản ứng giữa KMnO4 và SO2 có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
5.1. Trong Công Nghiệp
- Xử lý khí thải: Phản ứng này được sử dụng để loại bỏ SO2 khỏi khí thải công nghiệp, giúp giảm thiểu ô nhiễm môi trường và bảo vệ sức khỏe con người.
- Sản xuất hóa chất: KMnO4 được sử dụng làm chất oxy hóa trong nhiều quy trình sản xuất hóa chất, bao gồm sản xuất thuốc nhuộm, dược phẩm và các hợp chất hữu cơ khác.
5.2. Trong Phòng Thí Nghiệm
- Phân tích định lượng: Phản ứng này được sử dụng trong phương pháp chuẩn độ oxy hóa khử để xác định nồng độ của các chất khử, bao gồm SO2, Fe2+ và các chất hữu cơ.
- Nghiên cứu khoa học: Phản ứng giữa KMnO4 và SO2 được sử dụng trong các nghiên cứu về động học phản ứng, cơ chế phản ứng và các yếu tố ảnh hưởng đến tốc độ phản ứng.
5.3. Trong Đời Sống Hàng Ngày
- Khử trùng nước: KMnO4 có thể được sử dụng để khử trùng nước uống và nước sinh hoạt, tiêu diệt vi khuẩn và các vi sinh vật gây bệnh.
- Tẩy trắng: KMnO4 có khả năng tẩy trắng các vết bẩn trên vải và các vật liệu khác, nhưng cần sử dụng cẩn thận để tránh làm hỏng vật liệu.
6. Ưu Điểm và Nhược Điểm Của Việc Sử Dụng KMnO4 Để Xử Lý SO2
Việc sử dụng KMnO4 để xử lý SO2 có những ưu điểm và nhược điểm sau:
6.1. Ưu Điểm
- Hiệu quả cao: KMnO4 là một chất oxy hóa mạnh, có khả năng oxy hóa SO2 thành các sản phẩm ít độc hại hơn một cách nhanh chóng và hiệu quả.
- Dễ sử dụng: KMnO4 dễ dàng hòa tan trong nước và có thể được sử dụng trong các hệ thống xử lý khí thải đơn giản.
- Không tạo ra sản phẩm phụ độc hại: Phản ứng giữa KMnO4 và SO2 tạo ra các sản phẩm như MnSO4, K2SO4 và H2SO4, đều là các chất ít độc hại hơn SO2.
6.2. Nhược Điểm
- Chi phí cao: KMnO4 là một hóa chất đắt tiền, có thể làm tăng chi phí xử lý khí thải.
- Có thể tạo ra bùn thải: Quá trình xử lý có thể tạo ra bùn thải chứa MnSO4, cần được xử lý và tiêu hủy đúng cách để tránh gây ô nhiễm môi trường.
- Tính oxy hóa mạnh: KMnO4 có tính oxy hóa mạnh, có thể ăn mòn các thiết bị và vật liệu nếu không được sử dụng cẩn thận.
7. Các Phương Pháp Thay Thế KMnO4 Trong Xử Lý SO2
Ngoài KMnO4, còn có nhiều phương pháp khác được sử dụng để xử lý SO2 trong khí thải công nghiệp, bao gồm:
- Hấp thụ bằng dung dịch kiềm: Sử dụng các dung dịch kiềm như NaOH, Ca(OH)2 hoặc Mg(OH)2 để hấp thụ SO2, tạo thành các muối sulfit hoặc sulfat.
- Hấp phụ bằng vật liệu rắn: Sử dụng các vật liệu rắn như than hoạt tính, zeolit hoặc oxit kim loại để hấp phụ SO2 trên bề mặt.
- Oxy hóa xúc tác: Sử dụng các chất xúc tác để oxy hóa SO2 thành SO3, sau đó hấp thụ SO3 bằng axit sunfuric để tạo thành axit sunfuric đậm đặc.
Mỗi phương pháp có những ưu điểm và nhược điểm riêng, tùy thuộc vào điều kiện cụ thể của từng nhà máy và yêu cầu về hiệu quả xử lý.
8. Ví Dụ Minh Họa Về Phản Ứng KMnO4 và SO2
Để hiểu rõ hơn về phản ứng giữa KMnO4 và SO2, hãy xem xét ví dụ sau:
Bài toán: Cho 2,24 lít khí SO2 (đktc) hấp thụ hoàn toàn vào 100 ml dung dịch KMnO4 0,2M. Tính khối lượng MnSO4 tạo thành.
Giải:
-
Tính số mol SO2:
n(SO2) = V/22,4 = 2,24/22,4 = 0,1 mol
-
Tính số mol KMnO4:
n(KMnO4) = V x CM = 0,1 x 0,2 = 0,02 mol
-
Viết phương trình phản ứng:
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
-
Xác định chất hết, chất dư:
Theo phương trình, tỉ lệ mol giữa SO2 và KMnO4 là 5:2.
Ta có: n(SO2)/5 = 0,1/5 = 0,02 mol
n(KMnO4)/2 = 0,02/2 = 0,01 mol
Vậy SO2 dư, KMnO4 hết.
-
Tính số mol MnSO4 tạo thành:
Theo phương trình, số mol MnSO4 bằng số mol KMnO4.
n(MnSO4) = n(KMnO4) = 0,02 mol
-
Tính khối lượng MnSO4:
m(MnSO4) = n x M = 0,02 x 151 = 3,02 gam
Vậy khối lượng MnSO4 tạo thành là 3,02 gam.
9. Các Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng KMnO4 và SO2
Dưới đây là một số câu hỏi thường gặp liên quan đến phản ứng giữa KMnO4 và SO2:
-
Tại sao phản ứng giữa KMnO4 và SO2 làm mất màu dung dịch KMnO4?
- Do ion MnO4- (có màu tím) bị khử thành ion Mn2+ (không màu hoặc có màu hồng nhạt).
-
Phản ứng giữa KMnO4 và SO2 là phản ứng oxy hóa khử hay phản ứng axit bazơ?
- Đây là phản ứng oxy hóa khử, trong đó KMnO4 là chất oxy hóa và SO2 là chất khử.
-
Điều gì xảy ra nếu thêm quá nhiều SO2 vào dung dịch KMnO4?
- Dung dịch KMnO4 sẽ mất màu hoàn toàn và SO2 còn dư lại trong dung dịch.
-
KMnO4 có thể thay thế bằng chất oxy hóa nào khác để xử lý SO2 không?
- Có, có thể sử dụng các chất oxy hóa khác như H2O2, O3 hoặc Cl2.
-
Phản ứng giữa KMnO4 và SO2 có gây ô nhiễm môi trường không?
- Nếu không được xử lý đúng cách, các sản phẩm phụ của phản ứng như MnSO4 có thể gây ô nhiễm môi trường.
-
Ứng dụng nào quan trọng nhất của phản ứng giữa KMnO4 và SO2?
- Xử lý khí thải công nghiệp để giảm thiểu ô nhiễm môi trường.
-
Tại sao cần môi trường axit hoặc trung tính cho phản ứng xảy ra?
- Môi trường axit giúp phản ứng diễn ra nhanh hơn và hiệu quả hơn.
-
KMnO4 có độc hại không?
- KMnO4 là một chất oxy hóa mạnh và có thể gây kích ứng da, mắt và đường hô hấp. Cần sử dụng cẩn thận và tuân thủ các biện pháp an toàn.
-
Làm thế nào để bảo quản dung dịch KMnO4?
- Bảo quản trong chai lọ kín, tránh ánh sáng trực tiếp và nhiệt độ cao.
-
Phản ứng giữa KMnO4 và SO2 có ứng dụng trong y học không?
- KMnO4 có thể được sử dụng trong một số trường hợp để sát trùng vết thương, nhưng cần tuân thủ hướng dẫn của bác sĩ.
10. Tìm Hiểu Thêm Về Các Phản Ứng Hóa Học Tại CAUHOI2025.EDU.VN
Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về phản ứng giữa KMnO4 và SO2. Để tìm hiểu thêm về các phản ứng hóa học khác và các kiến thức khoa học thú vị, hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay! Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy những câu trả lời chính xác, đáng tin cậy và dễ hiểu cho mọi thắc mắc của mình. Đừng ngần ngại đặt câu hỏi để được các chuyên gia của chúng tôi tư vấn và giải đáp tận tình.
Bạn đang gặp khó khăn trong việc tìm kiếm thông tin chính xác và đáng tin cậy về hóa học? Bạn cảm thấy quá tải với vô vàn nguồn thông tin trên mạng? CAUHOI2025.EDU.VN sẽ giúp bạn giải quyết những thách thức này. Chúng tôi cung cấp câu trả lời rõ ràng, súc tích và được nghiên cứu kỹ lưỡng cho các câu hỏi thuộc nhiều lĩnh vực hóa học khác nhau. Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá thêm nhiều kiến thức hữu ích và đặt câu hỏi của riêng bạn!
Thông tin liên hệ:
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN