
Khối Lượng E Là Gì? Đặc Điểm, Cấu Tạo Và Bài Tập Liên Quan
Electron là một thuật ngữ được nhắc đến nhiều trong khoa học, nhưng không phải ai cũng hiểu rõ về chúng. Đây là một loại hạt cơ bản cấu tạo nên vật chất, đặc biệt là ở lớp vỏ của nguyên tử, với cấu trúc và khối lượng đặc trưng. Trong bài viết này, CAUHOI2025.EDU.VN sẽ phân tích chi tiết về electron, đặc biệt là Khối Lượng Của E, giúp bạn đọc có cái nhìn sâu sắc và toàn diện hơn.
1. Hạt Electron Là Gì?
Hạt electron, còn được gọi là điện tử, là một hạt hạ nguyên tử mang điện tích âm cơ bản. Ký hiệu của electron là e⁻. Điện tích của electron tương đương -1,6 x 10⁻¹⁹ Coulomb.
So với proton mang điện tích dương, electron có khối lượng nhỏ hơn rất nhiều, chỉ xấp xỉ 1/1836 lần. Electron chuyển động xung quanh hạt nhân nguyên tử và đóng vai trò quan trọng trong các hiện tượng nhiệt điện, hóa học, từ học và độ dẫn điện của vật chất. Theo một nghiên cứu của Viện Vật lý, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, electron là thành phần không thể thiếu trong mọi nguyên tử và quyết định tính chất hóa học của nguyên tố.

2. Đặc Điểm Nổi Bật Của Electron
Electron sở hữu những đặc tính độc đáo, khác biệt so với các hạt khác, làm nên vai trò quan trọng của chúng trong thế giới vật chất.
2.1. Tính Sóng – Hạt
Electron thể hiện đồng thời tính chất của cả sóng và hạt. Chúng vừa có thể phát xạ như một hạt vật chất, vừa có thể thể hiện tính chất giao thoa và nhiễu xạ như sóng ánh sáng. Ví dụ, trong thí nghiệm giao thoa điện tử, các electron hoạt động như sóng khi chúng truyền qua các khe hở, tạo ra các vân giao thoa trên màn chắn.
2.2. Khối Lượng Vô Cùng Nhỏ
Khối lượng của e rất nhỏ, chỉ khoảng 9,1094 x 10⁻³¹ kg. Do đó, các hiệu ứng cơ học lượng tử như hiệu ứng Compton và nguyên lý bất định Heisenberg có ảnh hưởng đáng kể đến hành vi của electron.
2.3. Tính Dẫn Điện
Electron có khả năng di chuyển dễ dàng trong vật chất, tạo nên tính dẫn điện. Khi có điện trường tác động, các electron tự do trong vật liệu sẽ chuyển động, tạo thành dòng điện. Độ dẫn điện của vật chất phụ thuộc vào số lượng electron tự do và khả năng di chuyển của chúng.
2.4. Spin – Lượng Tử Hóa
Electron có một tính chất lượng tử gọi là spin, được lượng tử hóa với hai giá trị là -1/2 hoặc +1/2. Spin của electron đóng vai trò quan trọng trong liên kết hóa học và tính chất từ tính của vật chất.
2.5. Tính Lưỡng Cực Từ
Electron tạo ra từ trường xung quanh nó do sự kết hợp giữa chuyển động quỹ đạo và spin. Đây là biểu hiện của tính lưỡng cực từ của electron.
3. Cấu Tạo Và Khối Lượng Của Electron
3.1. Cấu Tạo
Theo các mô hình hiện đại, electron không có cấu trúc bên trong đã biết. Chúng được coi là các hạt điểm, không chiếm không gian và không thể phân chia thành các thành phần nhỏ hơn. Kích thước của electron rất nhỏ, đến mức chúng ta không thể quan sát trực tiếp bằng mắt thường.
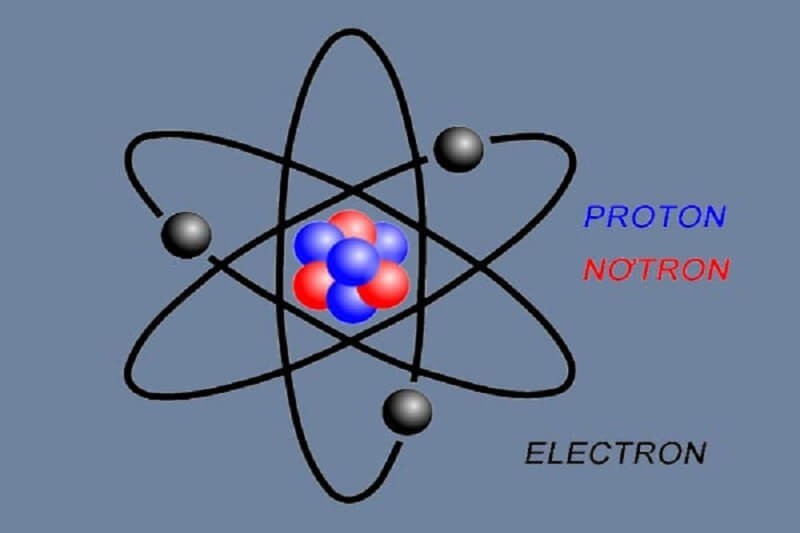
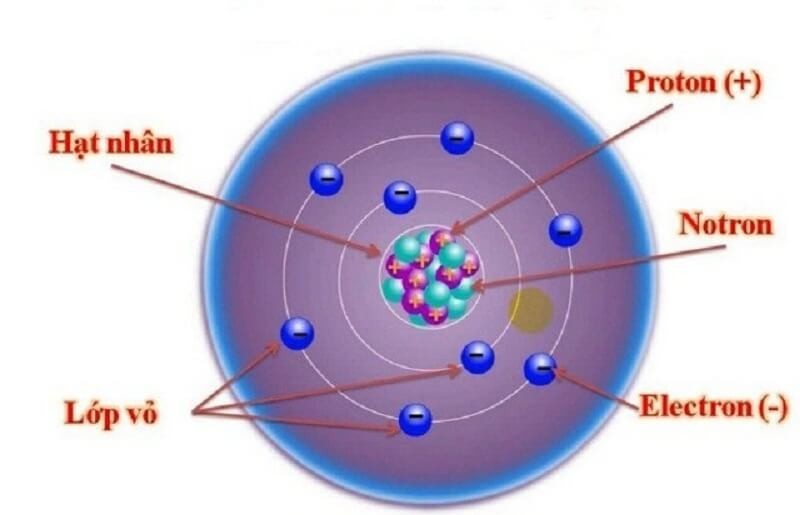
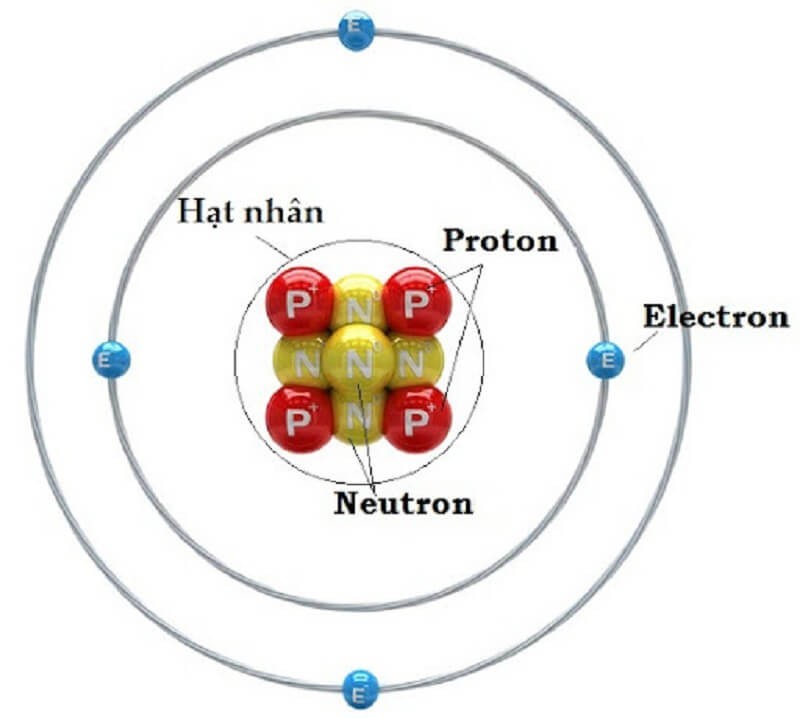
3.2. Các Thành Phần Cấu Tạo Nguyên Tử
Nguyên tử bao gồm hai phần chính: lớp vỏ và hạt nhân.
- Lớp vỏ: Lớp vỏ chứa các electron mang điện tích âm, sắp xếp thành các lớp khác nhau xung quanh hạt nhân. Mỗi lớp có một số lượng electron nhất định và chúng chuyển động không ngừng trong không gian xung quanh hạt nhân. Các electron rất nhẹ và bị hút bởi các proton mang điện tích dương trong hạt nhân.
- Hạt nhân: Hạt nhân nằm ở trung tâm của nguyên tử, có kích thước rất nhỏ so với toàn bộ nguyên tử (khoảng 10⁻⁵ đến 10⁻⁴ nm). Hạt nhân bao gồm các proton và neutron.
- Proton (ký hiệu p) mang điện tích dương (+1,602 x 10⁻¹⁹ C) và có khối lượng 1,6726 x 10⁻²⁷ kg.
- Neutron (ký hiệu n) không mang điện tích và có khối lượng 1,6748 x 10⁻²⁷ kg.
4. Khối Lượng Của Electron Là Bao Nhiêu?
Khối lượng của electron là một hằng số vật lý cơ bản, có giá trị khoảng 9,1093837015 × 10⁻³¹ kg. Con số này vô cùng nhỏ bé, nhưng lại đóng vai trò then chốt trong việc xác định tính chất của nguyên tử và các phản ứng hóa học.
4.1. Đơn Vị Khối Lượng Nguyên Tử (amu)
Trong hóa học, khối lượng của electron thường được biểu diễn dưới dạng đơn vị khối lượng nguyên tử (amu). Một amu được định nghĩa là 1/12 khối lượng của một nguyên tử carbon-12 ở trạng thái cơ bản.
Khối lượng của electron theo đơn vị amu là khoảng 0,00054858 amu. Giá trị này nhỏ hơn rất nhiều so với khối lượng của proton (1,00727 amu) và neutron (1,00866 amu).
4.2. Ảnh Hưởng Của Khối Lượng Electron Đến Tính Chất Vật Lý
Mặc dù khối lượng của electron rất nhỏ, nó vẫn ảnh hưởng đến các tính chất vật lý của vật chất. Ví dụ, do có khối lượng nhỏ, electron có thể dễ dàng di chuyển trong mạng tinh thể của kim loại, tạo ra dòng điện.
4.3. Mối Liên Hệ Giữa Khối Lượng Electron Và Năng Lượng
Theo phương trình nổi tiếng E=mc² của Einstein, năng lượng (E) và khối lượng (m) có mối liên hệ mật thiết với nhau, thông qua tốc độ ánh sáng (c). Do đó, khối lượng của electron cũng liên quan đến năng lượng mà nó mang.
5. Cách Viết Cấu Hình Electron
Cấu hình electron biểu diễn sự phân bố electron trong các lớp và phân lớp electron của một nguyên tử. Việc viết cấu hình electron giúp ta hiểu rõ hơn về tính chất hóa học của nguyên tố. Dưới đây là hướng dẫn từng bước viết cấu hình electron:
- Bước 1: Xác định số electron của nguyên tử dựa vào số hiệu nguyên tử (Z) trong bảng tuần hoàn.
- Bước 2: Phân bố electron vào các orbital (AO) theo thứ tự tăng dần năng lượng. Tuân thủ nguyên tắc Hund và nguyên lý Pauli.
- Bước 3: Viết cấu hình electron theo phân lớp trong mỗi lớp, theo thứ tự từ lớp trong cùng ra lớp ngoài cùng.
- Bước 4: Thu gọn cấu hình electron bằng cách sử dụng ký hiệu của khí hiếm gần nhất đứng trước nguyên tố đó trong bảng tuần hoàn.
Ví dụ: Nguyên tử Zn (kẽm) có Z = 30.
Số electron của Zn là 30e, được phân bố như sau: 1s²2s²2p⁶3s²3p⁶4s²3d¹⁰.
Vì lớp 3d¹⁰ và 4s² có mức năng lượng gần nhau, ta có thể viết thành: 1s²2s²2p⁶3s²3p⁶3d¹⁰4s². Sau đó, viết gọn lại là [Ar]3d¹⁰4s², trong đó [Ar] là cấu hình electron của nguyên tố Argon.
6. Bài Tập Về Khối Lượng Electron
Dưới đây là một số bài tập ví dụ liên quan đến khối lượng của e và cấu tạo nguyên tử, giúp bạn củng cố kiến thức:
Bài tập 1: So sánh nguyên tử Magie (Mg) và Cacbon (C). Nguyên tử nào nặng hơn và nặng hơn bao nhiêu lần?
Trả lời:
- Nguyên tử khối của Mg là 24 đvC.
- Nguyên tử khối của C là 12 đvC.
- Vậy, nguyên tử Magie nặng hơn nguyên tử Cacbon 2 lần.
Bài tập 2: Khối lượng của nguyên tử A gấp 4 lần khối lượng của nguyên tử Nitơ (N). Vậy khối lượng nguyên tử của A là bao nhiêu và A là nguyên tố nào?
Trả lời:
- Nitơ có nguyên tử khối là 14 đvC.
- Khối lượng nguyên tử của A là: 14 x 4 = 56 đvC.
- Vậy A là nguyên tố Sắt (Fe).
Bài tập 3: Tính số proton, neutron và electron có trong một ion Al³⁺. Biết nhôm có số hiệu nguyên tử là 13 và số khối là 27.
Trả lời:
- Số proton = số hiệu nguyên tử = 13
- Số electron = số proton – điện tích ion = 13 – 3 = 10
- Số neutron = số khối – số proton = 27 – 13 = 14
7. Ứng Dụng Của Electron Trong Đời Sống Và Khoa Học Kỹ Thuật
Electron đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và khoa học kỹ thuật:
- Điện tử học: Electron là thành phần cơ bản của các thiết bị điện tử như transistor, vi mạch, máy tính, điện thoại di động.
- Năng lượng: Electron tham gia vào quá trình tạo ra điện năng trong các nhà máy điện, pin mặt trời, pin nhiên liệu.
- Y học: Electron được sử dụng trong các thiết bị chẩn đoán hình ảnh như máy X-quang, máy CT scanner, máy MRI.
- Công nghiệp: Electron được ứng dụng trong các quy trình hàn điện, mạ điện, xử lý bề mặt vật liệu.
- Nghiên cứu khoa học: Electron là đối tượng nghiên cứu quan trọng trong vật lý, hóa học, sinh học, giúp các nhà khoa học hiểu sâu hơn về cấu trúc và tính chất của vật chất.
8. FAQ – Câu Hỏi Thường Gặp Về Electron
- Electron có kích thước bao nhiêu?
Electron được coi là hạt điểm, không có kích thước xác định. - Electron có thể bị phân chia không?
Theo hiểu biết hiện tại, electron là hạt cơ bản và không thể phân chia. - Electron có tồn tại độc lập không?
Electron có thể tồn tại độc lập trong một số điều kiện nhất định, ví dụ như trong chân không. - Electron có phải là sóng hay hạt?
Electron thể hiện cả tính chất sóng và hạt, tùy thuộc vào cách chúng ta quan sát và tương tác với chúng. - Khối lượng của electron có thay đổi không?
Khối lượng của electron là một hằng số vật lý và không thay đổi. - Tại sao electron không rơi vào hạt nhân?
Do tính chất lượng tử của electron và nguyên lý bất định Heisenberg, electron không thể xác định chính xác vị trí và vận tốc đồng thời, do đó chúng không thể rơi vào hạt nhân. - Electron có vai trò gì trong liên kết hóa học?
Electron là yếu tố chính tạo nên liên kết hóa học giữa các nguyên tử, thông qua việc chia sẻ hoặc trao đổi electron. - Electron có ảnh hưởng đến màu sắc của vật chất không?
Có, sự tương tác giữa electron và ánh sáng quyết định màu sắc của vật chất. - Electron có thể di chuyển nhanh đến mức nào?
Electron có thể di chuyển với tốc độ gần bằng tốc độ ánh sáng trong một số điều kiện nhất định. - Làm thế nào để đo được khối lượng của electron?
Khối lượng của electron được đo bằng các thí nghiệm vật lý chính xác, sử dụng các hiệu ứng như hiệu ứng Zeeman và hiệu ứng Compton.
9. Kết Luận
Electron là một hạt cơ bản vô cùng quan trọng, đóng vai trò then chốt trong cấu tạo vật chất và các hiện tượng tự nhiên. Hiểu rõ về khối lượng của e, cấu trúc và tính chất của electron giúp chúng ta khám phá sâu hơn về thế giới xung quanh và ứng dụng chúng vào nhiều lĩnh vực khác nhau.
Nếu bạn có bất kỳ thắc mắc nào về electron hoặc các vấn đề liên quan đến khoa học tự nhiên, hãy truy cập CAUHOI2025.EDU.VN để tìm kiếm câu trả lời và được tư vấn bởi các chuyên gia. CauHoi2025.EDU.VN luôn sẵn sàng cung cấp thông tin chính xác, đáng tin cậy và dễ hiểu cho tất cả mọi người. Liên hệ với chúng tôi qua địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc số điện thoại +84 2435162967.
Các từ khóa LSI: điện tích electron, cấu hình electron, hạt hạ nguyên tử.

