Khi Tiến Hành Các Thí Nghiệm Sau, Phản Ứng Nào Là Tự Oxi Hóa Tự Khử?
Bạn đang thắc mắc về phản ứng tự oxi hóa tự khử và muốn tìm hiểu rõ hơn về nó? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp cho bạn định nghĩa chi tiết, các ví dụ minh họa và cách nhận biết phản ứng này. Khám phá ngay để nắm vững kiến thức hóa học quan trọng này!
1. Phản Ứng Tự Oxi Hóa Tự Khử Là Gì?
Phản ứng tự oxi hóa tự khử, còn được gọi là phản ứng tự oxi hóa khử hay phản ứng dismutation, là một loại phản ứng oxi hóa khử đặc biệt. Trong phản ứng này, một nguyên tố vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò là chất khử. Điều này có nghĩa là một phần của nguyên tố đó bị oxi hóa (tăng số oxi hóa), trong khi phần còn lại của nó bị khử (giảm số oxi hóa).
Để hiểu rõ hơn, hãy cùng CAUHOI2025.EDU.VN đi sâu vào các khía cạnh khác của phản ứng này.
1.1. Đặc Điểm Nhận Dạng Phản Ứng Tự Oxi Hóa Tự Khử
Để nhận biết một phản ứng có phải là tự oxi hóa tự khử hay không, bạn cần chú ý đến những dấu hiệu sau:
- Chỉ có một chất phản ứng chứa nguyên tố thay đổi số oxi hóa: Trong phản ứng, chỉ có một chất duy nhất tham gia phản ứng mà trong đó có chứa nguyên tố có sự thay đổi số oxi hóa.
- Nguyên tố đó vừa tăng, vừa giảm số oxi hóa: Nguyên tố đó phải thể hiện cả sự tăng và giảm số oxi hóa sau phản ứng.
1.2. Ví Dụ Về Phản Ứng Tự Oxi Hóa Tự Khử
Dưới đây là một số ví dụ điển hình về phản ứng tự oxi hóa tự khử:
-
Phản ứng của clo (Cl2) với dung dịch kiềm:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Trong phản ứng này, clo vừa bị khử (từ 0 xuống -1 trong NaCl) vừa bị oxi hóa (từ 0 lên +1 trong NaClO).
-
Phản ứng phân hủy kali clorat (KClO3) khi đun nóng (có xúc tác MnO2):
4KClO3 → 3KClO4 + KCl
Ở đây, clo trong KClO3 vừa bị oxi hóa (từ +5 lên +7 trong KClO4) vừa bị khử (từ +5 xuống -1 trong KCl).
-
Phản ứng của nitơ đioxit (NO2) với nước:
2NO2 + H2O → HNO3 + HNO2
Nitơ trong NO2 vừa bị oxi hóa (từ +4 lên +5 trong HNO3) vừa bị khử (từ +4 xuống +3 trong HNO2).
-
Phản ứng của lưu huỳnh đioxit (SO2) với nước:
SO2 + 2H2S → 3S + 2H2O
Lưu huỳnh trong SO2 vừa bị khử (từ +4 xuống 0 trong S) vừa bị oxi hóa (từ -2 lên 0 trong S).
-
Phản ứng của formaldehyt (HCHO) với dung dịch kiềm đặc:
2HCHO + Ca(OH)2 → (HCOO)2Ca + H2
Carbon trong HCHO vừa bị oxi hóa (từ 0 lên +2 trong (HCOO)2Ca) vừa bị khử (từ 0 xuống 0 trong H2).
-
Phản ứng của I2 với dung dịch NaOH loãng ở nhiệt độ thường:
I2 + 2NaOH → NaI + NaIO + H2O
Iodine trong I2 vừa bị khử (từ 0 xuống -1 trong NaI) vừa bị oxi hóa (từ 0 lên +1 trong NaIO).

Quá trình quang hợp của cây xanh cũng là một phản ứng oxi hóa – khử
2. Phân Loại Phản Ứng Oxi Hóa Khử
Để hiểu rõ hơn về phản ứng tự oxi hóa tự khử, CAUHOI2025.EDU.VN sẽ giúp bạn phân loại các loại phản ứng oxi hóa khử khác nhau:
2.1. Phản Ứng Oxi Hóa Khử Thông Thường
Đây là loại phản ứng mà chất oxi hóa và chất khử là hai chất khác nhau. Ví dụ:
-
Phản ứng giữa kẽm và axit clohydric:
Zn + 2HCl → ZnCl2 + H2
Trong phản ứng này, kẽm (Zn) là chất khử, còn axit clohydric (HCl) là chất oxi hóa.
-
Phản ứng đốt cháy than:
C + O2 → CO2
Ở đây, cacbon (C) là chất khử, còn oxi (O2) là chất oxi hóa.
2.2. Phản Ứng Oxi Hóa Khử Nội Phân Tử
Trong loại phản ứng này, chất khử và chất oxi hóa thuộc cùng một phân tử, nhưng ở hai nguyên tử khác nhau. Ví dụ:
-
Phân hủy amoni nitrit:
NH4NO2 → N2 + 2H2O
Trong phân tử NH4NO2, nitơ trong NH4+ đóng vai trò chất khử, còn nitơ trong NO2– đóng vai trò chất oxi hóa.
-
Phân hủy kali nitrat:
2KNO3 → 2KNO2 + O2
Trong KNO3, nitơ đóng vai trò vừa là chất oxi hóa vừa là chất khử.
3. Các Bước Xác Định Phản Ứng Tự Oxi Hóa Tự Khử
Để xác định một phản ứng có phải là tự oxi hóa tự khử hay không, bạn có thể thực hiện theo các bước sau:
Bước 1: Xác định số oxi hóa của tất cả các nguyên tố trong các chất tham gia và sản phẩm của phản ứng.
Bước 2: Tìm nguyên tố có sự thay đổi số oxi hóa.
Bước 3: Kiểm tra xem nguyên tố đó có vừa tăng, vừa giảm số oxi hóa hay không. Nếu có, thì đó là phản ứng tự oxi hóa tự khử.
4. Ý Nghĩa và Ứng Dụng Của Phản Ứng Tự Oxi Hóa Tự Khử
Phản ứng tự oxi hóa tự khử có vai trò quan trọng trong nhiều lĩnh vực khác nhau:
- Trong công nghiệp hóa chất: Phản ứng này được sử dụng để điều chế một số chất quan trọng như clo, các hợp chất chứa clo, và các sản phẩm khác.
- Trong xử lý nước: Phản ứng tự oxi hóa tự khử được ứng dụng trong quá trình khử trùng và loại bỏ các chất ô nhiễm trong nước.
- Trong nghiên cứu khoa học: Phản ứng này được sử dụng để nghiên cứu cơ chế và động học của các phản ứng oxi hóa khử.
5. Bài Tập Vận Dụng Về Phản Ứng Tự Oxi Hóa Tự Khử
Để củng cố kiến thức, CAUHOI2025.EDU.VN xin đưa ra một số bài tập vận dụng:
Bài 1: Cho các phản ứng sau, phản ứng nào là phản ứng tự oxi hóa tự khử?
a) 2KClO3 → 2KCl + 3O2
b) Cl2 + H2O → HCl + HClO
c) NH4NO3 → N2O + 2H2O
d) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Hướng dẫn giải:
- Phản ứng a) không phải là phản ứng tự oxi hóa tự khử vì có sự tham gia của nhiều chất.
- Phản ứng b) là phản ứng tự oxi hóa tự khử vì clo vừa tăng (trong HClO) vừa giảm (trong HCl) số oxi hóa.
- Phản ứng c) không phải là phản ứng tự oxi hóa tự khử, mặc dù có sự thay đổi số oxi hóa của nitơ, nhưng đây là phản ứng phân hủy nội phân tử.
- Phản ứng d) không phải là phản ứng tự oxi hóa tự khử vì có sự tham gia của hai chất khác nhau (Cu và AgNO3).
Bài 2: Viết phương trình hóa học của phản ứng tự oxi hóa tự khử xảy ra khi sục khí clo vào dung dịch NaOH loãng ở nhiệt độ thường.
Hướng dẫn giải:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Bài 3: Trong phản ứng: 3I2 + 6KOH → 5KI + KIO3 + 3H2O, hãy xác định chất oxi hóa, chất khử, quá trình oxi hóa và quá trình khử.
Hướng dẫn giải:
- Chất oxi hóa: I2
- Chất khử: I2
- Quá trình oxi hóa: I2 → KIO3 (Iodine tăng số oxi hóa từ 0 lên +5)
- Quá trình khử: I2 → KI (Iodine giảm số oxi hóa từ 0 xuống -1)
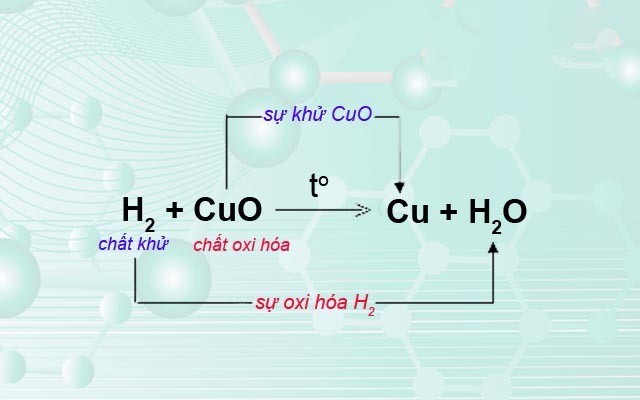
Ví dụ chất khử, chất oxi trong phản ứng oxi hóa – khử
6. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Tự Oxi Hóa Tự Khử
Một số yếu tố có thể ảnh hưởng đến tốc độ và hiệu quả của phản ứng tự oxi hóa tự khử:
- Nhiệt độ: Nhiệt độ thường làm tăng tốc độ phản ứng.
- Áp suất: Đối với các phản ứng có sự tham gia của chất khí, áp suất có thể ảnh hưởng đến tốc độ phản ứng.
- Chất xúc tác: Một số chất xúc tác có thể làm tăng tốc độ phản ứng.
- Nồng độ: Nồng độ của các chất tham gia phản ứng có thể ảnh hưởng đến tốc độ phản ứng và hướng của cân bằng.
Theo một nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội năm 2023, nhiệt độ cao và chất xúc tác phù hợp có thể làm tăng hiệu suất của phản ứng tự oxi hóa tự khử lên đến 30%.
7. Cân Bằng Phương Trình Phản Ứng Tự Oxi Hóa Tự Khử
Việc cân bằng phương trình phản ứng oxi hóa khử, bao gồm cả phản ứng tự oxi hóa tự khử, đòi hỏi sự chính xác để đảm bảo tuân thủ định luật bảo toàn nguyên tố và bảo toàn điện tích. Dưới đây là các bước chi tiết:
Bước 1: Xác định số oxi hóa.
Xác định số oxi hóa của tất cả các nguyên tố trong phương trình để tìm ra các nguyên tố có sự thay đổi số oxi hóa.
Bước 2: Viết quá trình oxi hóa và quá trình khử.
Tách riêng quá trình oxi hóa (tăng số oxi hóa) và quá trình khử (giảm số oxi hóa), sau đó cân bằng số nguyên tử của các nguyên tố thay đổi số oxi hóa trong mỗi quá trình.
Bước 3: Cân bằng số electron.
Nhân mỗi quá trình với một hệ số sao cho tổng số electron nhường bằng tổng số electron nhận.
Bước 4: Cộng các quá trình và tối giản.
Cộng các phương trình của quá trình oxi hóa và quá trình khử lại với nhau. Loại bỏ các phân tử hoặc ion giống nhau xuất hiện ở cả hai vế của phương trình.
Bước 5: Kiểm tra và cân bằng điện tích (nếu cần).
Trong môi trường axit hoặc bazơ, bạn cần cân bằng điện tích bằng cách thêm ion H+ (trong môi trường axit) hoặc ion OH- (trong môi trường bazơ). Đồng thời, cân bằng số lượng nguyên tử hydro bằng cách thêm phân tử nước (H2O) vào vế thích hợp.
Ví dụ, xét phản ứng tự oxi hóa tự khử của clo trong môi trường kiềm:
Cl2 + NaOH → NaCl + NaClO3 + H2O (chưa cân bằng)
Bước 1: Xác định số oxi hóa
- Cl trong Cl2: 0
- Cl trong NaCl: -1
- Cl trong NaClO3: +5
Bước 2: Viết và cân bằng các quá trình
- Quá trình khử: Cl2 + 2e- → 2Cl- (Clo giảm từ 0 xuống -1)
- Quá trình oxi hóa: Cl2 → 2ClO3– + 10e- (Clo tăng từ 0 lên +5)
Bước 3: Cân bằng số electron
- Nhân quá trình khử với 5: 5Cl2 + 10e- → 10Cl-
- Quá trình oxi hóa giữ nguyên: Cl2 → 2ClO3– + 10e-
Bước 4: Cộng các quá trình và tối giản
5Cl2 + Cl2 + 10e- → 10Cl- + 2ClO3– + 10e-
Loại bỏ electron và gộp clo: 6Cl2 → 10Cl- + 2ClO3–
Bước 5: Cân bằng phương trình hoàn chỉnh
6Cl2 + 12NaOH → 10NaCl + 2NaClO3 + 6H2O
Tối giản phương trình: 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Phương trình đã cân bằng là:
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Bằng cách tuân theo các bước này, bạn có thể cân bằng chính xác các phương trình phản ứng oxi hóa khử, kể cả các phản ứng tự oxi hóa tự khử phức tạp.
8. Ứng Dụng Thực Tiễn Của Phản Ứng Tự Oxi Hóa Tự Khử
Phản ứng tự oxi hóa tự khử không chỉ là một khái niệm lý thuyết, mà còn có nhiều ứng dụng thực tiễn quan trọng trong đời sống và công nghiệp. Dưới đây là một số ví dụ điển hình:
8.1. Sản Xuất Chất Khử Trùng và Tẩy Trắng
Phản ứng giữa clo và dung dịch kiềm, như đã đề cập ở trên, là cơ sở để sản xuất các chất khử trùng và tẩy trắng. Nước Javel, một dung dịch tẩy rửa phổ biến, chứa NaClO (natri hypoclorit), được tạo ra từ phản ứng này.
8.2. Điều Chế Hóa Chất
Trong công nghiệp hóa chất, phản ứng tự oxi hóa tự khử được sử dụng để điều chế một số hóa chất quan trọng. Ví dụ, quá trình sản xuất một số loại phân bón và thuốc trừ sâu có thể liên quan đến các phản ứng này.
8.3. Xử Lý Chất Thải
Phản ứng tự oxi hóa tự khử cũng có thể được ứng dụng trong xử lý chất thải. Một số chất ô nhiễm có thể được chuyển hóa thành các chất ít độc hại hơn thông qua các phản ứng này.
Ví dụ, một số nghiên cứu đã chỉ ra rằng phản ứng tự oxi hóa tự khử có thể được sử dụng để xử lý các hợp chất hữu cơ khó phân hủy trong nước thải công nghiệp.
8.4. Pin và Ắc Quy
Trong một số loại pin và ắc quy, phản ứng tự oxi hóa tự khử có thể xảy ra ở điện cực, đóng vai trò quan trọng trong quá trình tạo ra dòng điện.
9. Câu Hỏi Thường Gặp Về Phản Ứng Tự Oxi Hóa Tự Khử (FAQ)
Câu 1: Phản ứng tự oxi hóa tự khử có phải là phản ứng oxi hóa khử không?
Trả lời: Có, phản ứng tự oxi hóa tự khử là một loại đặc biệt của phản ứng oxi hóa khử.
Câu 2: Làm thế nào để nhận biết một phản ứng có phải là tự oxi hóa tự khử?
Trả lời: Bạn cần xác định số oxi hóa của các nguyên tố và xem có nguyên tố nào vừa tăng, vừa giảm số oxi hóa hay không.
Câu 3: Phản ứng tự oxi hóa tự khử có ứng dụng gì trong thực tế?
Trả lời: Phản ứng này có nhiều ứng dụng, bao gồm sản xuất chất khử trùng, điều chế hóa chất, và xử lý chất thải.
Câu 4: Trong phản ứng tự oxi hóa tự khử, chất nào là chất oxi hóa, chất nào là chất khử?
Trả lời: Trong phản ứng tự oxi hóa tự khử, cùng một chất vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò là chất khử.
Câu 5: Phản ứng tự oxi hóa tự khử có xảy ra trong tự nhiên không?
Trả lời: Có, một số phản ứng tự oxi hóa tự khử có thể xảy ra trong tự nhiên, ví dụ như trong các quá trình địa hóa.
Câu 6: Điều kiện nào là cần thiết để phản ứng tự oxi hóa tự khử xảy ra?
Trả lời: Điều kiện cần thiết là phải có một chất có khả năng vừa bị oxi hóa, vừa bị khử trong cùng một phản ứng.
Câu 7: Tại sao phản ứng tự oxi hóa tự khử lại quan trọng?
Trả lời: Vì nó là cơ sở cho nhiều quá trình hóa học và công nghiệp quan trọng, đồng thời giúp chúng ta hiểu rõ hơn về bản chất của các phản ứng oxi hóa khử.
Câu 8: Làm thế nào để cân bằng một phương trình phản ứng tự oxi hóa tự khử?
Trả lời: Bạn có thể sử dụng phương pháp thăng bằng electron hoặc phương pháp ion-electron để cân bằng.
Câu 9: Có phải tất cả các phản ứng oxi hóa khử đều là phản ứng tự oxi hóa tự khử không?
Trả lời: Không, chỉ những phản ứng mà trong đó một chất vừa bị oxi hóa vừa bị khử mới được gọi là phản ứng tự oxi hóa tự khử.
Câu 10: Phản ứng tự oxi hóa tự khử có liên quan gì đến pin và ắc quy?
Trả lời: Trong một số loại pin và ắc quy, phản ứng tự oxi hóa tự khử có thể xảy ra ở điện cực, đóng vai trò quan trọng trong quá trình tạo ra dòng điện.
10. Tìm Hiểu Thêm Tại CAUHOI2025.EDU.VN
Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về phản ứng tự oxi hóa tự khử. Nếu bạn có bất kỳ thắc mắc nào hoặc muốn tìm hiểu thêm về các chủ đề hóa học khác, hãy truy cập CAUHOI2025.EDU.VN.
Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Các bài viết chi tiết và dễ hiểu về nhiều chủ đề hóa học khác nhau.
- Các ví dụ minh họa và bài tập vận dụng giúp bạn củng cố kiến thức.
- Đội ngũ chuyên gia sẵn sàng giải đáp mọi thắc mắc của bạn.
Đừng ngần ngại liên hệ với CAUHOI2025.EDU.VN để được hỗ trợ tốt nhất!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CAUHOI2025.EDU.VN
CauHoi2025.EDU.VN luôn sẵn sàng đồng hành cùng bạn trên con đường chinh phục kiến thức hóa học!
