Nitơ Hóa Trị Mấy? Giải Thích Chi Tiết và Ứng Dụng Thực Tế
Nitơ là một nguyên tố hóa học thiết yếu cho sự sống và có nhiều ứng dụng quan trọng trong công nghiệp, nông nghiệp và y học. Vậy nitơ hóa trị mấy? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp thông tin chi tiết về hóa trị của nitơ, tính chất và các ứng dụng thực tế của nó.
Giới thiệu
Nitơ (N) là một nguyên tố phi kim phổ biến, chiếm khoảng 78% khí quyển Trái Đất. Nó là một thành phần quan trọng của protein, axit nucleic và các phân tử sinh học khác. Do đó, nitơ đóng vai trò then chốt trong sự sống.
Tuy nhiên, nitơ cũng là một nguyên tố hóa học có nhiều trạng thái oxy hóa khác nhau, dẫn đến sự đa dạng về hóa trị. Việc hiểu rõ về hóa trị của nitơ là rất quan trọng để dự đoán và giải thích các phản ứng hóa học liên quan đến nó. CAUHOI2025.EDU.VN sẽ giúp bạn khám phá sâu hơn về vấn đề này.
1. Nitơ Là Gì?
Nitơ là một nguyên tố hóa học với ký hiệu N và số nguyên tử 7. Công thức hóa học của nitơ là N2, cho thấy nó tồn tại ở dạng phân tử gồm hai nguyên tử nitơ liên kết với nhau. Nitơ là một chất khí không màu, không mùi, không vị và tương đối trơ ở điều kiện thường.
1.1. Vai Trò Của Nitơ Trong Tự Nhiên
Nitơ đóng vai trò quan trọng trong nhiều quá trình sinh học và địa hóa. Nó là một thành phần thiết yếu của protein, axit nucleic và các phân tử hữu cơ khác. Nitơ cũng là một phần của chu trình nitơ, một quá trình phức tạp trong đó nitơ được chuyển đổi giữa các dạng khác nhau bởi vi sinh vật và các quá trình tự nhiên khác.
1.2. Các Dạng Tồn Tại Của Nitơ
Nitơ tồn tại ở nhiều dạng khác nhau trong tự nhiên, bao gồm:
- Nitơ phân tử (N2): Dạng khí chiếm phần lớn khí quyển.
- Nitơ vô cơ: Amoniac (NH3), nitrat (NO3-), nitrit (NO2-).
- Nitơ hữu cơ: Amin, amide, protein.

2. Vậy Nitơ Hóa Trị Mấy?
Nitơ có thể có nhiều hóa trị khác nhau, tùy thuộc vào hợp chất mà nó tham gia. Các hóa trị phổ biến của nitơ bao gồm:
- Hóa trị III: Trong amoniac (NH3) và các amin.
- Hóa trị II: Trong nitơ monoxide (NO).
- Hóa trị IV: Trong nitơ dioxide (NO2).
- Hóa trị V: Trong axit nitric (HNO3) và các nitrat.
Sự đa dạng về hóa trị này là do cấu hình electron của nitơ, với 5 electron ở lớp ngoài cùng, cho phép nó tạo thành nhiều liên kết khác nhau.
2.1. Giải Thích Về Hóa Trị Của Nitơ
Hóa trị của một nguyên tố được xác định bởi số lượng electron mà nó có thể cho, nhận hoặc chia sẻ để tạo thành liên kết hóa học. Nitơ có 5 electron hóa trị, do đó nó có thể tạo thành tối đa 3 liên kết cộng hóa trị hoặc nhận 3 electron để tạo thành ion nitrua (N3-).
2.2. Ví Dụ Về Hóa Trị Của Nitơ Trong Các Hợp Chất
Để hiểu rõ hơn về hóa trị của nitơ, chúng ta hãy xem xét một số ví dụ:
- Amoniac (NH3): Nitơ có hóa trị III, vì nó chia sẻ 3 electron với 3 nguyên tử hydro.
- Nitơ monoxide (NO): Nitơ có hóa trị II, vì nó chia sẻ 2 electron với một nguyên tử oxy.
- Nitơ dioxide (NO2): Nitơ có hóa trị IV, vì nó chia sẻ 4 electron với hai nguyên tử oxy.
- Axit nitric (HNO3): Nitơ có hóa trị V, vì nó chia sẻ 5 electron với một nguyên tử hydro và ba nguyên tử oxy.
3. Số Oxi Hóa Của Nitơ
Số oxi hóa là một khái niệm khác, biểu thị điện tích mà một nguyên tử sẽ có nếu tất cả các liên kết của nó là ion. Nitơ có thể có các số oxi hóa từ -3 đến +5.
3.1. Mối Quan Hệ Giữa Hóa Trị và Số Oxi Hóa
Trong nhiều trường hợp, hóa trị và số oxi hóa có thể giống nhau, nhưng chúng không phải lúc nào cũng vậy. Ví dụ, trong amoniac (NH3), nitơ có hóa trị III và số oxi hóa -3. Tuy nhiên, trong nitơ dioxide (NO2), nitơ có hóa trị IV nhưng số oxi hóa là +4.
3.2. Bảng Số Oxi Hóa Phổ Biến Của Nitơ
Dưới đây là bảng tóm tắt các số oxi hóa phổ biến của nitơ:
| Số Oxi Hóa | Ví Dụ |
|---|---|
| -3 | Amoniac (NH3), ion nitrua (N3-) |
| -2 | Hydrazine (N2H4) |
| -1 | Hydroxylamine (NH2OH) |
| 0 | Nitơ phân tử (N2) |
| +1 | Nitơ monoxide (N2O) |
| +2 | Nitơ monoxide (NO) |
| +3 | Nitơ trioxide (N2O3), axit nitrơ (HNO2) |
| +4 | Nitơ dioxide (NO2) |
| +5 | Nitơ pentoxide (N2O5), axit nitric (HNO3) |
4. Tính Chất Của Nitơ
Nitơ có cả tính chất vật lý và hóa học đặc trưng, ảnh hưởng đến các ứng dụng của nó.
4.1. Tính Chất Vật Lý
Nitơ là một chất khí không màu, không mùi, không vị và nhẹ hơn không khí. Nó ít tan trong nước và hóa rắn ở nhiệt độ rất thấp (-210°C). Nitơ lỏng được sử dụng rộng rãi làm chất làm lạnh.
Một số thông tin khác về nitơ:
- Ký hiệu nguyên tử: N
- Số hiệu nguyên tử: 7, thuộc nhóm VA
- Số oxi hóa: -3, 0, +1, +2, +3, +4, +5
- Nhiệt độ sôi: 77,36K
- Nhiệt độ nóng chảy: 63,15K

4.2. Tính Chất Hóa Học
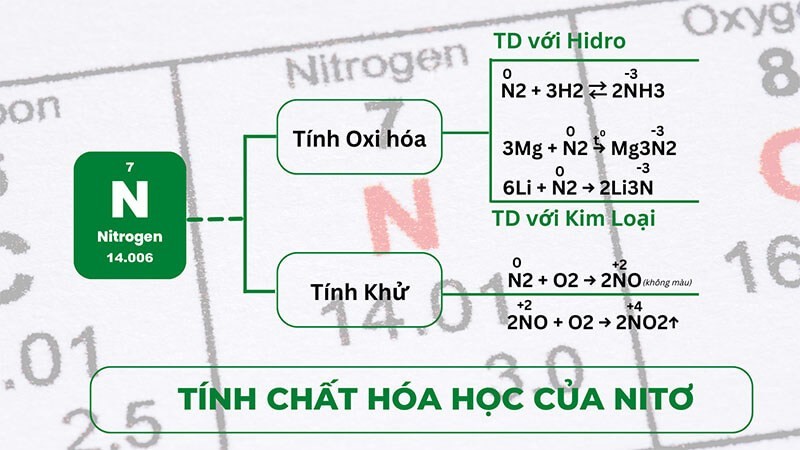
Nitơ tương đối trơ ở nhiệt độ thường, nhưng trở nên hoạt động hơn ở nhiệt độ cao. Nó có thể phản ứng với nhiều nguyên tố khác nhau, thể hiện cả tính khử và tính oxy hóa.
4.2.1. Tính Khử Của Nitơ
Nitơ có tính khử khi phản ứng với các nguyên tố có độ âm điện lớn hơn, đặc biệt ở nhiệt độ cao. Ví dụ, nitơ phản ứng với oxy ở nhiệt độ cao để tạo thành nitơ monoxide:
N2 + O2 → 2NO (không màu)
Trong phản ứng này, nitơ (N2) có số oxi hóa 0, và nitơ trong nitơ monoxide (NO) có số oxi hóa +2.
Ở điều kiện thường, nitơ monoxide có thể tác dụng với oxy trong không khí để tạo thành nitơ dioxide có màu nâu đỏ:
2NO + O2 → 2NO2
Trong phản ứng này, nitơ trong NO2 có số oxi hóa +4.
4.2.2. Tính Oxy Hóa Của Nitơ
Nitơ có tính oxy hóa khi tác dụng với các nguyên tố có độ âm điện nhỏ hơn, như kim loại và hydro.
- Tác dụng với kim loại: Ở điều kiện thường, nitơ chỉ tác dụng với liti (Li) để tạo thành liti nitrua:
6Li + N2 → 2Li3N
Ở nhiệt độ cao, nitơ có thể tác dụng với nhiều kim loại khác tạo thành nitrua. Các nitrua này dễ bị thủy phân tạo thành amoniac (NH3):
3Mg + N2 → Mg3N2
- Tác dụng với hydro: Nitơ phản ứng với hydro ở nhiệt độ và áp suất cao, có xúc tác, để tạo thành amoniac:
N2 + 3H2 ⇌ 2NH3
5. Ứng Dụng Của Nitơ
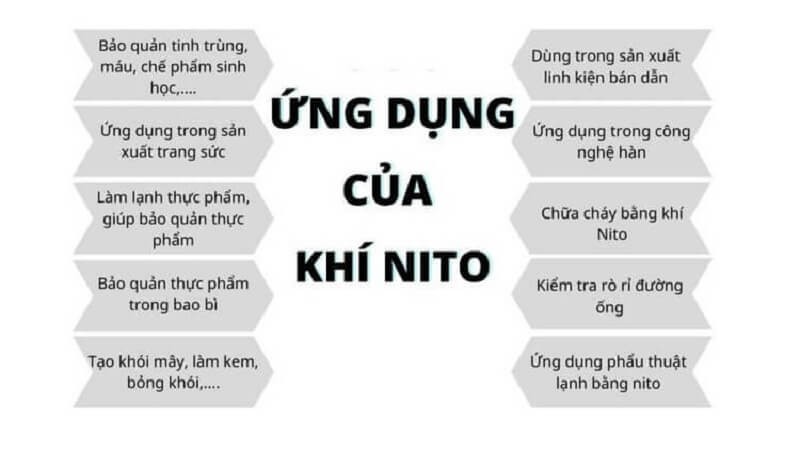
Nitơ có rất nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau.
5.1. Trong Công Nghiệp
- Sản xuất amoniac: Amoniac được sử dụng để sản xuất phân bón, axit nitric và các hóa chất khác.
- Sản xuất thép không gỉ: Nitơ được sử dụng để tạo ra thép không gỉ có độ bền cao và khả năng chống ăn mòn tốt.
- Làm mát: Nitơ lỏng được sử dụng để làm mát các thiết bị điện tử, máy móc và trong các ứng dụng y tế.
- Bảo quản thực phẩm: Nitơ được sử dụng để bảo quản thực phẩm bằng cách ngăn chặn sự oxy hóa và sự phát triển của vi sinh vật.
5.2. Trong Nông Nghiệp
- Phân bón: Các hợp chất nitơ như amoni nitrat, ure và amoni sunfat được sử dụng làm phân bón để cung cấp nitơ cho cây trồng.
- Bảo quản hạt giống: Nitơ lỏng được sử dụng để bảo quản hạt giống trong thời gian dài.
5.3. Trong Y Học
- Bảo quản mẫu sinh học: Nitơ lỏng được sử dụng để bảo quản các mẫu sinh học như tế bào, mô và cơ quan.
- Phẫu thuật lạnh: Nitơ lỏng được sử dụng trong phẫu thuật lạnh để đóng băng và phá hủy các mô bệnh.
- Da liễu: Nitơ lỏng được sử dụng để điều trị các bệnh da như mụn cóc và sẹo lồi.
5.4. Các Ứng Dụng Khác
- Bơm lốp xe: Nitơ được sử dụng để bơm lốp xe, giúp duy trì áp suất ổn định và kéo dài tuổi thọ của lốp.
- Sản xuất thuốc nổ: Một số hợp chất nitơ như nitroglycerin được sử dụng làm thuốc nổ.
- Trong nghiên cứu khoa học: Nitơ được sử dụng trong nhiều thí nghiệm và nghiên cứu khoa học.
6. Điều Chế Nitơ
Nitơ có thể được điều chế bằng nhiều phương pháp khác nhau, tùy thuộc vào quy mô và mục đích sử dụng.
6.1. Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, nitơ thường được điều chế bằng cách nhiệt phân muối amoni nitrit:
NH4NO2 → N2 + 2H2O
Tuy nhiên, amoni nitrit là một chất không bền, dễ gây nổ, nên thường được điều chế ngay trước khi sử dụng bằng cách trộn dung dịch natri nitrit (NaNO2) với dung dịch amoni clorua (NH4Cl):
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
6.2. Trong Công Nghiệp
Trong công nghiệp, nitơ được điều chế chủ yếu bằng phương pháp chưng cất phân đoạn không khí lỏng. Không khí được hóa lỏng ở nhiệt độ rất thấp, sau đó được đun nóng từ từ. Nitơ có nhiệt độ sôi thấp hơn oxy, nên sẽ bay hơi trước và được thu gom.
Nitơ thu được bằng phương pháp này có độ tinh khiết cao và được sử dụng rộng rãi trong các ngành công nghiệp khác nhau.
7. An Toàn Khi Sử Dụng Nitơ
Mặc dù nitơ là một chất khí trơ, nhưng nó vẫn có thể gây nguy hiểm nếu không được sử dụng đúng cách.
7.1. Ngạt Thở
Nitơ không độc, nhưng nó có thể gây ngạt thở nếu nồng độ oxy trong không khí giảm xuống quá thấp. Điều này có thể xảy ra trong các không gian kín, nơi nitơ chiếm chỗ của oxy.
7.2. Bỏng Lạnh
Nitơ lỏng có thể gây bỏng lạnh nếu tiếp xúc với da. Do đó, cần sử dụng các biện pháp bảo hộ thích hợp khi làm việc với nitơ lỏng.
7.3. Áp Suất Cao
Nitơ được lưu trữ và vận chuyển dưới áp suất cao. Các bình chứa nitơ cần được bảo quản và sử dụng cẩn thận để tránh rò rỉ hoặc nổ.
8. FAQ – Câu Hỏi Thường Gặp Về Nitơ và Hóa Trị
Dưới đây là một số câu hỏi thường gặp về nitơ và hóa trị của nó:
1. Tại sao nitơ lại có nhiều hóa trị khác nhau?
Nitơ có 5 electron hóa trị, cho phép nó tạo thành nhiều liên kết khác nhau, dẫn đến sự đa dạng về hóa trị.
2. Hóa trị phổ biến nhất của nitơ là gì?
Hóa trị phổ biến nhất của nitơ là III, như trong amoniac (NH3).
3. Số oxi hóa của nitơ trong nitơ phân tử (N2) là bao nhiêu?
Số oxi hóa của nitơ trong nitơ phân tử (N2) là 0.
4. Nitơ có độc không?
Nitơ không độc, nhưng nó có thể gây ngạt thở nếu nồng độ oxy trong không khí giảm xuống quá thấp.
5. Nitơ lỏng được sử dụng để làm gì?
Nitơ lỏng được sử dụng rộng rãi làm chất làm lạnh, bảo quản mẫu sinh học và trong phẫu thuật lạnh.
6. Làm thế nào để điều chế nitơ trong phòng thí nghiệm?
Nitơ có thể được điều chế trong phòng thí nghiệm bằng cách nhiệt phân muối amoni nitrit hoặc bằng cách trộn dung dịch natri nitrit với dung dịch amoni clorua.
7. Ứng dụng quan trọng nhất của nitơ là gì?
Một trong những ứng dụng quan trọng nhất của nitơ là sản xuất amoniac, được sử dụng để sản xuất phân bón.
8. Làm thế nào để bảo quản thực phẩm bằng nitơ?
Nitơ có tính trơ, nên nó có thể ngăn chặn sự oxy hóa tốt. Vì thế, sử dụng nitơ để bảo quản thực phẩm là một trong những biện pháp hữu ích.
9. Tại sao nitơ lại quan trọng đối với sự sống?
Nitơ là một thành phần thiết yếu của protein, axit nucleic và các phân tử sinh học khác, đóng vai trò quan trọng trong sự sống.
10. Nitơ có thể gây bỏng không?
Nitơ lỏng có thể gây bỏng lạnh nếu tiếp xúc với da.
Kết Luận
Nitơ là một nguyên tố hóa học quan trọng với nhiều hóa trị và ứng dụng khác nhau. Hiểu rõ về hóa trị của nitơ, tính chất và các ứng dụng của nó là rất quan trọng trong nhiều lĩnh vực khoa học và công nghiệp. CAUHOI2025.EDU.VN hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích và thú vị về nitơ.
Nếu bạn có bất kỳ câu hỏi nào khác về nitơ hoặc các chủ đề hóa học khác, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để tìm kiếm câu trả lời hoặc đặt câu hỏi trực tiếp. Chúng tôi luôn sẵn sàng hỗ trợ bạn!
Để khám phá thêm nhiều kiến thức bổ ích và thú vị, hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay. Tại đây, bạn sẽ tìm thấy vô số thông tin hữu ích, được trình bày một cách dễ hiểu và hấp dẫn. Đừng bỏ lỡ cơ hội nâng cao hiểu biết của bạn!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN
