
Hạt Nào Mang Điện Tích Dương? Giải Thích Chi Tiết Từ A Đến Z
Bạn đang thắc mắc Hạt Nào Mang điện Tích Dương? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp câu trả lời chi tiết và dễ hiểu nhất, đồng thời mở rộng kiến thức về cấu tạo nguyên tử và các hạt cơ bản. Chúng ta sẽ cùng nhau khám phá thế giới vi mô đầy thú vị này!
Đoạn Giới Thiệu
Bạn có bao giờ tự hỏi vật chất xung quanh ta được cấu tạo từ những gì? Câu trả lời nằm trong thế giới của các nguyên tử, và để hiểu rõ hơn, chúng ta cần biết về các hạt cơ bản. Bài viết này của CAUHOI2025.EDU.VN sẽ giải đáp chi tiết câu hỏi “hạt nào mang điện tích dương” và cung cấp kiến thức nền tảng về cấu trúc nguyên tử, giúp bạn nắm vững kiến thức khoa học cơ bản. Hãy cùng khám phá proton, neutron, electron và vai trò của chúng trong việc tạo nên thế giới vật chất.
1. Hạt Nào Mang Điện Tích Dương Trong Nguyên Tử?
Hạt proton mang điện tích dương. Proton là một trong ba loại hạt cơ bản cấu tạo nên nguyên tử, cùng với neutron và electron. Điện tích của proton được quy ước là +1.
1.1. Định Nghĩa Chi Tiết Về Proton
Proton là một hạt hạ nguyên tử, có nghĩa là nó nhỏ hơn nguyên tử. Nó nằm trong hạt nhân của nguyên tử, cùng với neutron. Số lượng proton trong hạt nhân xác định nguyên tố hóa học của nguyên tử đó. Ví dụ, tất cả các nguyên tử hydro đều có một proton, tất cả các nguyên tử heli đều có hai proton, và cứ thế tiếp tục.
1.2. Khối Lượng và Điện Tích Của Proton
- Khối lượng: Proton có khối lượng khoảng 1 atomic mass unit (amu) hoặc 1.67262 × 10^-27 kg.
- Điện tích: Điện tích của proton là +1.602 × 10^-19 coulombs, đây là một đơn vị điện tích dương cơ bản.
1.3. Vai Trò Quan Trọng Của Proton Trong Nguyên Tử
Proton đóng vai trò cực kỳ quan trọng trong việc xác định tính chất hóa học của một nguyên tố. Số lượng proton (số nguyên tử) quyết định vị trí của nguyên tố đó trong bảng tuần hoàn các nguyên tố hóa học. Hơn nữa, proton tạo ra lực đẩy tĩnh điện với các proton khác trong hạt nhân, nhưng lực hạt nhân mạnh giữ chúng lại với nhau, đảm bảo sự ổn định của hạt nhân.
2. Các Hạt Cơ Bản Khác Trong Nguyên Tử
Bên cạnh proton, nguyên tử còn được cấu tạo từ hai loại hạt cơ bản khác là neutron và electron.
2.1. Neutron: Hạt Không Mang Điện
- Định nghĩa: Neutron là một hạt hạ nguyên tử không mang điện tích, nằm trong hạt nhân của nguyên tử cùng với proton.
- Khối lượng: Neutron có khối lượng xấp xỉ bằng khối lượng của proton, khoảng 1 amu.
- Vai trò: Neutron đóng vai trò quan trọng trong việc ổn định hạt nhân nguyên tử. Chúng tạo ra lực hạt nhân mạnh, giúp cân bằng lực đẩy tĩnh điện giữa các proton. Số lượng neutron có thể khác nhau ở các nguyên tử của cùng một nguyên tố, tạo ra các đồng vị.
2.2. Electron: Hạt Mang Điện Tích Âm
- Định nghĩa: Electron là một hạt hạ nguyên tử mang điện tích âm (-1), chuyển động xung quanh hạt nhân nguyên tử theo các quỹ đạo nhất định.
- Khối lượng: Electron có khối lượng rất nhỏ so với proton và neutron, chỉ khoảng 0.00055 amu.
- Vai trò: Electron quyết định tính chất hóa học của nguyên tử. Sự tương tác giữa các electron của các nguyên tử khác nhau tạo ra các liên kết hóa học, hình thành nên các phân tử và hợp chất.

Alt: Mô hình cấu tạo nguyên tử Lithium, thể hiện proton, neutron trong hạt nhân và electron quay quanh hạt nhân.
3. Điện Tích Của Nguyên Tử: Trạng Thái Trung Hòa
Trong trạng thái bình thường, một nguyên tử là trung hòa về điện. Điều này có nghĩa là số lượng proton (điện tích dương) bằng với số lượng electron (điện tích âm). Nếu số lượng proton và electron không bằng nhau, nguyên tử sẽ trở thành ion, mang điện tích dương (cation) hoặc điện tích âm (anion).
3.1. Ion Dương (Cation)
Ion dương được hình thành khi một nguyên tử mất electron. Vì số lượng proton nhiều hơn số lượng electron, ion này mang điện tích dương. Ví dụ, ion natri (Na+) được hình thành khi nguyên tử natri mất một electron.
3.2. Ion Âm (Anion)
Ion âm được hình thành khi một nguyên tử nhận thêm electron. Vì số lượng electron nhiều hơn số lượng proton, ion này mang điện tích âm. Ví dụ, ion clo (Cl-) được hình thành khi nguyên tử clo nhận thêm một electron.
4. Ứng Dụng Của Kiến Thức Về Điện Tích Trong Hóa Học và Vật Lý
Hiểu biết về điện tích của các hạt cơ bản và nguyên tử có rất nhiều ứng dụng trong hóa học và vật lý, từ việc giải thích các phản ứng hóa học đến phát triển các công nghệ mới.
4.1. Giải Thích Liên Kết Hóa Học
Liên kết hóa học là lực hút giữa các nguyên tử, giữ chúng lại với nhau để tạo thành phân tử hoặc hợp chất. Có nhiều loại liên kết hóa học khác nhau, nhưng tất cả đều dựa trên sự tương tác giữa các electron của các nguyên tử.
- Liên kết ion: Liên kết ion được hình thành khi một nguyên tử nhường electron cho một nguyên tử khác, tạo thành ion dương và ion âm. Lực hút tĩnh điện giữa các ion trái dấu này tạo ra liên kết ion. Ví dụ, liên kết trong muối ăn (NaCl) là liên kết ion.
- Liên kết cộng hóa trị: Liên kết cộng hóa trị được hình thành khi các nguyên tử chia sẻ electron với nhau. Ví dụ, liên kết trong phân tử nước (H2O) là liên kết cộng hóa trị.
4.2. Ứng Dụng Trong Điện Hóa Học
Điện hóa học là ngành khoa học nghiên cứu về mối quan hệ giữa điện và hóa học. Các phản ứng điện hóa là các phản ứng hóa học xảy ra khi có dòng điện chạy qua. Điện hóa học có rất nhiều ứng dụng, bao gồm:
- Pin và ắc quy: Pin và ắc quy là các thiết bị chuyển đổi năng lượng hóa học thành năng lượng điện.
- Điện phân: Điện phân là quá trình sử dụng dòng điện để phân hủy các hợp chất hóa học.
- Mạ điện: Mạ điện là quá trình sử dụng dòng điện để phủ một lớp kim loại mỏng lên bề mặt của một vật khác.
4.3. Ứng Dụng Trong Vật Lý Hạt Nhân
Vật lý hạt nhân là ngành khoa học nghiên cứu về cấu trúc và tính chất của hạt nhân nguyên tử. Kiến thức về proton, neutron và các hạt khác trong hạt nhân rất quan trọng để hiểu các hiện tượng như phân hạch hạt nhân, tổng hợp hạt nhân và phóng xạ.
5. Lịch Sử Phát Triển Của Mô Hình Nguyên Tử
Mô hình nguyên tử đã trải qua một quá trình phát triển lâu dài, từ những ý tưởng sơ khai của các nhà triết học Hy Lạp cổ đại đến mô hình lượng tử hiện đại.
5.1. Mô Hình Của Democritus
Vào khoảng năm 440 trước Công nguyên, nhà triết học Hy Lạp Democritus cho rằng vật chất được cấu tạo từ các hạt nhỏ không thể phân chia được gọi là “atomos” (nguyên tử).
5.2. Mô Hình Của John Dalton
Vào đầu thế kỷ 19, nhà hóa học người Anh John Dalton đưa ra mô hình nguyên tử dựa trên các bằng chứng thực nghiệm. Ông cho rằng:
- Mỗi nguyên tố hóa học được cấu tạo từ các nguyên tử giống hệt nhau.
- Các nguyên tử của các nguyên tố khác nhau có khối lượng khác nhau.
- Các hợp chất được tạo thành từ sự kết hợp của các nguyên tử theo tỷ lệ đơn giản.
5.3. Mô Hình “Bánh Pudding Nho” Của J.J. Thomson
Vào cuối thế kỷ 19, J.J. Thomson phát hiện ra electron và đưa ra mô hình nguyên tử “bánh pudding nho”. Ông cho rằng nguyên tử là một khối cầu tích điện dương, trong đó các electron (mang điện tích âm) được phân bố rải rác như những hạt nho trong bánh pudding.
5.4. Mô Hình Hành Tinh Nguyên Tử Của Ernest Rutherford
Vào đầu thế kỷ 20, Ernest Rutherford thực hiện thí nghiệm tán xạ hạt alpha và đưa ra mô hình hành tinh nguyên tử. Ông cho rằng nguyên tử có một hạt nhân nhỏ bé mang điện tích dương, tập trung hầu hết khối lượng của nguyên tử. Các electron chuyển động xung quanh hạt nhân theo các quỹ đạo giống như các hành tinh quay quanh mặt trời.
5.5. Mô Hình Nguyên Tử Của Niels Bohr
Niels Bohr cải tiến mô hình của Rutherford bằng cách đưa ra các tiên đề về lượng tử hóa năng lượng. Ông cho rằng electron chỉ có thể chuyển động trên các quỹ đạo có năng lượng xác định. Khi electron chuyển từ quỹ đạo này sang quỹ đạo khác, nó sẽ hấp thụ hoặc phát ra một photon có năng lượng tương ứng.
5.6. Mô Hình Lượng Tử Hiện Đại
Mô hình lượng tử hiện đại mô tả electron không chỉ là các hạt mà còn có tính chất sóng. Thay vì chuyển động trên các quỹ đạo xác định, electron tồn tại trong các vùng không gian xung quanh hạt nhân gọi là orbital.
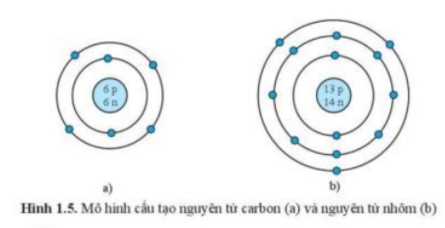
Alt: Hình ảnh mô tả cấu tạo nguyên tử carbon với các lớp electron.
6. Tìm Hiểu Sâu Hơn Về Các Hạt Hạ Nguyên Tử
Ngoài proton, neutron và electron, các nhà vật lý còn khám phá ra nhiều hạt hạ nguyên tử khác, cấu tạo nên proton và neutron.
6.1. Quark
Quark là các hạt cơ bản cấu tạo nên hadron, bao gồm proton và neutron. Có sáu loại quark khác nhau: up, down, charm, strange, top và bottom. Proton được cấu tạo từ hai quark up và một quark down (uud), trong khi neutron được cấu tạo từ một quark up và hai quark down (udd).
6.2. Lepton
Lepton là một loại hạt cơ bản khác, không tham gia vào lực tương tác mạnh. Electron là một loại lepton. Các lepton khác bao gồm muon, tau và neutrino.
6.3. Boson
Boson là các hạt truyền tải lực. Ví dụ, photon là boson truyền tải lực điện từ, gluon là boson truyền tải lực hạt nhân mạnh, và boson W và Z là boson truyền tải lực hạt nhân yếu.
7. Bảng Tổng Hợp Các Hạt Cơ Bản
Để dễ dàng hình dung và so sánh, dưới đây là bảng tổng hợp các hạt cơ bản cấu tạo nên nguyên tử:
| Hạt | Vị trí | Điện tích | Khối lượng (amu) | Vai trò |
|---|---|---|---|---|
| Proton | Hạt nhân | +1 | 1.00727 | Xác định nguyên tố hóa học, tạo lực đẩy tĩnh điện trong hạt nhân |
| Neutron | Hạt nhân | 0 | 1.00866 | Ổn định hạt nhân, tạo lực hạt nhân mạnh |
| Electron | Vỏ nguyên tử | -1 | 0.00055 | Quyết định tính chất hóa học, tạo liên kết hóa học |
8. Các Câu Hỏi Thường Gặp (FAQ)
Câu 1: Hạt nào trong nguyên tử không mang điện?
Trả lời: Hạt neutron không mang điện.
Câu 2: Điện tích của electron là bao nhiêu?
Trả lời: Điện tích của electron là -1.602 × 10^-19 coulombs.
Câu 3: Số lượng proton trong hạt nhân cho biết điều gì?
Trả lời: Số lượng proton trong hạt nhân xác định nguyên tố hóa học của nguyên tử.
Câu 4: Ion dương được hình thành như thế nào?
Trả lời: Ion dương được hình thành khi một nguyên tử mất electron.
Câu 5: Hạt quark cấu tạo nên hạt nào?
Trả lời: Hạt quark cấu tạo nên proton và neutron.
Câu 6: Electron chuyển động xung quanh hạt nhân như thế nào?
Trả lời: Electron chuyển động xung quanh hạt nhân theo các orbital, là các vùng không gian có xác suất tìm thấy electron cao nhất.
Câu 7: Tại sao nguyên tử lại trung hòa về điện?
Trả lời: Vì số lượng proton (điện tích dương) bằng với số lượng electron (điện tích âm).
Câu 8: Liên kết hóa học nào được hình thành do lực hút giữa các ion trái dấu?
Trả lời: Liên kết ion.
Câu 9: Mô hình nguyên tử hiện đại nhất hiện nay là mô hình nào?
Trả lời: Mô hình lượng tử hiện đại.
Câu 10: Đơn vị đo khối lượng của các hạt trong nguyên tử là gì?
Trả lời: Đơn vị đo khối lượng của các hạt trong nguyên tử là atomic mass unit (amu).
9. Kết Luận
Hy vọng rằng bài viết này của CAUHOI2025.EDU.VN đã giúp bạn hiểu rõ hơn về hạt nào mang điện tích dương và các kiến thức liên quan đến cấu tạo nguyên tử. Việc nắm vững những kiến thức cơ bản này sẽ giúp bạn dễ dàng tiếp thu các kiến thức hóa học và vật lý nâng cao hơn. Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để tìm kiếm câu trả lời!
CAUHOI2025.EDU.VN luôn sẵn sàng cung cấp cho bạn những thông tin chính xác, đáng tin cậy và dễ hiểu nhất. Hãy khám phá thêm nhiều chủ đề thú vị khác trên trang web của chúng tôi!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967.
Trang web: CAUHOI2025.EDU.VN
Hãy liên hệ với chúng tôi nếu bạn cần thêm thông tin hoặc có bất kỳ thắc mắc nào. CauHoi2025.EDU.VN luôn đồng hành cùng bạn trên con đường chinh phục tri thức!

