Công Thức Nồng Độ Phần Trăm: Giải Thích Chi Tiết, Ví Dụ & Bài Tập
Bạn đang gặp khó khăn trong việc tính toán nồng độ phần trăm dung dịch? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp Công Thức Nồng độ phần trăm chuẩn xác nhất, cách áp dụng vào giải bài tập hóa học, cùng những lưu ý quan trọng. Khám phá ngay để nắm vững kiến thức và tự tin chinh phục các bài toán hóa học!
1. Nồng Độ Dung Dịch Là Gì?
Nồng độ dung dịch là một khái niệm quan trọng cho biết lượng chất tan có trong một lượng dung dịch nhất định. Nói một cách đơn giản, nó cho biết dung dịch đặc hay loãng. Theo Sách giáo khoa Hóa học lớp 8 (Nhà xuất bản Giáo dục Việt Nam), nồng độ dung dịch có thể được điều chỉnh bằng cách thay đổi lượng chất tan hoặc dung môi.
- Tăng nồng độ: Giảm lượng dung môi hoặc thêm chất tan.
- Giảm nồng độ: Giảm lượng chất tan hoặc thêm dung môi.
Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan ở một nhiệt độ nhất định. Đây là trạng thái dung dịch có nồng độ cao nhất.
2. Nồng Độ Phần Trăm (C%) Là Gì?
Trong hóa học, nồng độ phần trăm (C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. Đây là một cách biểu thị nồng độ phổ biến, giúp dễ dàng hình dung tỷ lệ chất tan trong toàn bộ dung dịch.

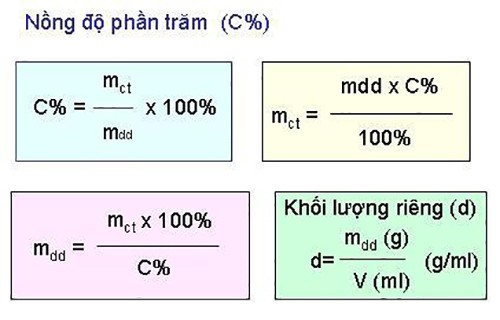
3. Công Thức Tính Nồng Độ Phần Trăm Chuẩn Xác Nhất
Công thức tính nồng độ phần trăm (C%) được xác định như sau:
C% = (mct / mdd) x 100%
Trong đó:
- C%: Nồng độ phần trăm của dung dịch
- mct: Khối lượng chất tan (gam)
- mdd: Khối lượng dung dịch (gam)
Lưu ý: Khối lượng dung dịch bằng tổng khối lượng chất tan và khối lượng dung môi:
mdd = mct + mdm
Trong đó:
- mdm: Khối lượng dung môi (gam)
Công thức này rất quan trọng để giải các bài tập liên quan đến nồng độ phần trăm. Hãy đảm bảo bạn hiểu rõ từng thành phần và cách áp dụng chúng.
4. Hướng Dẫn Chi Tiết Cách Sử Dụng Công Thức Tính Nồng Độ Phần Trăm
Để tính nồng độ phần trăm của một chất trong dung dịch sau phản ứng, bạn cần thực hiện theo các bước sau:
Bước 1: Xác Định Các Chất Có Trong Dung Dịch Sau Phản Ứng
Đặc biệt chú ý đến lượng chất dư của các chất tham gia phản ứng. Điều này giúp xác định chính xác thành phần của dung dịch sau phản ứng.
Bước 2: Xác Định Khối Lượng Dung Dịch Sau Phản Ứng
Sử dụng công thức sau:
mdd = mchất tan thêm vào + mdung môi – mchất kết tủa – mchất khí
Trong đó:
- mchất tan thêm vào: Tổng khối lượng các chất tan được cho vào dung dịch.
- mdung môi: Khối lượng dung môi ban đầu.
- mchất kết tủa: Tổng khối lượng các chất kết tủa tạo thành sau phản ứng (nếu có).
- mchất khí: Tổng khối lượng các chất khí thoát ra sau phản ứng (nếu có).
Việc xác định đúng khối lượng dung dịch là yếu tố then chốt để tính toán chính xác nồng độ phần trăm.
Bước 3: Tìm Khối Lượng Chất Tan Cần Xác Định
Dựa vào phương trình phản ứng và số mol của các chất, tính toán khối lượng chất tan cần tìm.
Bước 4: Áp Dụng Công Thức Tính Nồng Độ Phần Trăm
Sử dụng công thức C% = (mct / mdd) x 100% để tính nồng độ phần trăm của chất tan.
5. Những Lưu Ý Quan Trọng Khi Tính Nồng Độ Phần Trăm
Để đảm bảo tính chính xác khi tính toán nồng độ phần trăm, hãy lưu ý những điều sau:
- Đọc kỹ đề bài: Xác định rõ các thông tin đã cho và yêu cầu của bài toán.
- Nhớ chính xác công thức: Tránh nhầm lẫn giữa các công thức tính nồng độ khác nhau.
- Cẩn thận trong tính toán: Kiểm tra kỹ các bước tính toán để tránh sai sót.
- Đổi đơn vị (nếu cần): Đảm bảo tất cả các đơn vị đều thống nhất trước khi thực hiện phép tính. Ví dụ, nếu đề bài cho thể tích dung dịch (ml), bạn cần đổi sang lít (L) nếu công thức yêu cầu đơn vị lít.
- Xác định đúng chất tan và dung môi: Trong nhiều trường hợp, việc xác định chính xác chất nào là chất tan, chất nào là dung môi là rất quan trọng.
- Kiểm tra lại kết quả: Sau khi tính toán, hãy kiểm tra lại kết quả để đảm bảo tính hợp lý.

6. Mối Quan Hệ Giữa Nồng Độ Phần Trăm và Các Nồng Độ Dung Dịch Khác
Nồng độ phần trăm có mối liên hệ mật thiết với các loại nồng độ khác, đặc biệt là nồng độ mol (CM). Công thức liên hệ giữa nồng độ mol và nồng độ phần trăm của chất tan có phân tử khối M là:
CM = (10 x D x C%) / M
Trong đó:
- CM: Nồng độ mol (mol/lít)
- D: Khối lượng riêng của dung dịch (g/ml)
- C%: Nồng độ phần trăm
- M: Phân tử khối của chất tan
Công thức này cho phép chuyển đổi giữa nồng độ phần trăm và nồng độ mol, giúp giải quyết các bài toán hóa học phức tạp hơn.
7. Nồng Độ Mol (CM) Là Gì? Công Thức Tính Nồng Độ Mol
7.1. Khái Niệm Nồng Độ Mol và Công Thức Tính
Nồng độ mol (CM) là đại lượng biểu thị số mol chất tan có trong một lít dung dịch. Theo định nghĩa trong Sách giáo khoa Hóa học lớp 12 (Nhà xuất bản Giáo dục Việt Nam), nồng độ mol cho biết lượng chất tan trong một thể tích dung dịch xác định.
Công thức tính nồng độ mol:
CM = n / V
Trong đó:
- CM: Nồng độ mol (mol/lít, hoặc M)
- n: Số mol chất tan (mol)
- V: Thể tích dung dịch (lít)
Để tính nồng độ mol, bạn cần xác định số mol chất tan và thể tích dung dịch. Đôi khi, đề bài sẽ cho khối lượng chất tan và bạn cần chuyển đổi sang số mol bằng công thức:
n = m / M
Trong đó:
- m: Khối lượng chất tan (gam)
- M: Phân tử khối của chất tan (g/mol)
7.2. Các Dạng Bài Tập Tính Nồng Độ Mol
Xác định nồng độ mol từ số mol và thể tích
Nồng độ mol được tính bằng số mol chất tan chia cho thể tích dung dịch (tính bằng lít).
Ví dụ: Tính nồng độ mol của dung dịch chứa 0.75 mol NaCl trong 4.2 lít dung dịch.
Lời giải:
CM = 0.75 mol / 4.2 lít = 0.179 M
Xác định nồng độ mol từ khối lượng và thể tích
Nồng độ mol được tính bằng khối lượng chất tan chia cho phân tử khối của chất tan, sau đó chia cho thể tích dung dịch (tính bằng lít).
Ví dụ: Tính nồng độ mol của dung dịch khi hòa tan 3.4g KMnO4 trong 5.2 lít nước.
Lời giải:
- Số mol KMnO4 = 3.4g / 158 g/mol = 0.0215 mol
- CM = 0.0215 mol / 5.2 lít = 0.004 M
Xác định nồng độ mol từ số mol và ml dung dịch
Tương tự như trên, nhưng cần đổi đơn vị thể tích từ ml sang lít trước khi tính toán.
Ví dụ: Tính nồng độ mol của một dung dịch chứa 1.2 mol CaCl2 trong 2905 ml nước.
Lời giải:
- 2905 ml = 2.905 lít
- CM = 1.2 mol / 2.905 lít = 0.413 M
8. Bài Tập Áp Dụng Tính Nồng Độ Phần Trăm
Để củng cố kiến thức, hãy cùng giải một số bài tập áp dụng công thức tính nồng độ phần trăm:
Bài tập 1: Hòa tan hoàn toàn 20 gam NaCl vào 40 gam nước. Tính nồng độ phần trăm của dung dịch.
Lời giải:
- Khối lượng dung dịch: mdd = mct + mdm = 20 + 40 = 60 gam
- Nồng độ phần trăm: C% = (mct / mdd) x 100% = (20 / 60) x 100% = 33.3%
Vậy nồng độ phần trăm của dung dịch NaCl là 33.3%.
Bài tập 2: Hòa tan 10 gam đường vào 40 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Lời giải:
- Khối lượng dung dịch: mdd = mct + mdm = 10 + 40 = 50 gam
- Nồng độ phần trăm: C% = (mct / mdd) x 100% = (10 / 50) x 100% = 20%
Vậy nồng độ phần trăm của dung dịch đường là 20%.
Bài tập 3: Hòa tan CaCO3 vào 200g dung dịch HCl 7.3% (vừa đủ). Tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng.
Lời giải:
- Khối lượng HCl trong 200g dung dịch HCl 7.3%: mHCl = (C% x mdd) / 100% = (7.3 x 200) / 100 = 14.6 gam
- Số mol HCl: nHCl = 14.6 / 36.5 = 0.4 mol
- Phương trình phản ứng: CaCO3 + 2HCl → CaCl2 + H2O + CO2
- Số mol CaCO3 = Số mol CaCl2 = Số mol CO2 = nHCl / 2 = 0.2 mol
- Khối lượng CaCO3: mCaCO3 = 0.2 x 100 = 20 gam
- Khối lượng CaCl2: mCaCl2 = 0.2 x 111 = 22.2 gam
- Khối lượng CO2: mCO2 = 0.2 x 44 = 8.8 gam
- Khối lượng dung dịch sau phản ứng: mdd = mCaCO3 + mdd HCl – mCO2 = 20 + 200 – 8.8 = 211.2 gam
- Nồng độ phần trăm của CaCl2: C%CaCl2 = (mCaCl2 / mdd) x 100% = (22.2 / 211.2) x 100% = 10.51%
Bài tập 4: Cho 400g dung dịch NaOH 20% tác dụng vừa đủ với 200g dung dịch HCl, sinh ra NaCl và H2O. Tính nồng độ phần trăm của muối sinh ra sau phản ứng.
Lời giải:
- Khối lượng NaOH: mNaOH = (mdd x C%) / 100 = (400 x 20) / 100 = 80 gam
- Số mol NaOH: nNaOH = 80 / 40 = 2 mol
- Phương trình phản ứng: NaOH + HCl → NaCl + H2O
- Số mol NaCl = Số mol NaOH = 2 mol
- Khối lượng NaCl: mNaCl = 2 x 58.5 = 117 gam
- Khối lượng dung dịch sau phản ứng: mdd = mdd NaOH + mdd HCl = 400 + 200 = 600 gam
- Nồng độ phần trăm của NaCl: C%NaCl = (mNaCl / mdd) x 100% = (117 / 600) x 100% = 19.5%
Bài tập 5: Tiến hành hòa tan 3.9 gam Kali vào 36.2 gam nước, thu được dung dịch B. Tính nồng độ phần trăm của dung dịch B.
Lời giải:
- Phương trình phản ứng: 2K + 2H2O → 2KOH + H2
- Số mol K: nK = 3.9 / 39 = 0.1 mol
- Số mol KOH = Số mol K = 0.1 mol
- Số mol H2 = nK / 2 = 0.05 mol
- Khối lượng dung dịch: mdd = mK + mH2O – mH2 = 3.9 + 36.2 – (0.05 x 2) = 40 gam
- Nồng độ phần trăm của KOH: C%KOH = (mKOH / mdd) x 100% = (5.6 / 40) x 100% = 14%
9. FAQ – Câu Hỏi Thường Gặp Về Nồng Độ Phần Trăm
1. Nồng độ phần trăm cho biết điều gì?
Nồng độ phần trăm cho biết số gam chất tan có trong 100 gam dung dịch.
2. Công thức tính nồng độ phần trăm là gì?
C% = (mct / mdd) x 100%
3. Làm thế nào để tính khối lượng dung dịch?
mdd = mct + mdm
4. Nồng độ phần trăm có đơn vị không?
Nồng độ phần trăm có đơn vị là %, nhưng không phải là đơn vị đo lường thực tế.
5. Làm thế nào để chuyển đổi giữa nồng độ phần trăm và nồng độ mol?
Sử dụng công thức: CM = (10 x D x C%) / M
6. Dung dịch bão hòa là gì?
Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan ở một nhiệt độ nhất định.
7. Tại sao cần lưu ý khi tính toán nồng độ phần trăm?
Để đảm bảo tính chính xác của kết quả.
8. Làm thế nào để xác định chất tan và dung môi?
Chất tan là chất được hòa tan, thường có lượng ít hơn. Dung môi là chất dùng để hòa tan, thường có lượng nhiều hơn.
9. Nếu đề bài cho thể tích dung dịch, tôi cần làm gì?
Bạn cần biết khối lượng riêng của dung dịch để chuyển đổi thể tích sang khối lượng.
10. Nồng độ phần trăm có ứng dụng gì trong thực tế?
Nồng độ phần trăm được sử dụng rộng rãi trong hóa học, dược phẩm, thực phẩm và nhiều ngành công nghiệp khác.
Nắm vững công thức và các bước tính toán, bạn sẽ dễ dàng giải quyết các bài tập liên quan đến nồng độ phần trăm. CAUHOI2025.EDU.VN hy vọng bài viết này đã cung cấp cho bạn những kiến thức hữu ích.
Bạn vẫn còn thắc mắc về công thức nồng độ hoặc cần giải đáp các bài tập hóa học khác? Đừng ngần ngại truy cập CAUHOI2025.EDU.VN để khám phá thêm nhiều kiến thức hữu ích và đặt câu hỏi để được các chuyên gia hỗ trợ! Liên hệ với chúng tôi tại địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc qua số điện thoại +84 2435162967. CauHoi2025.EDU.VN luôn sẵn sàng đồng hành cùng bạn trên con đường chinh phục tri thức!