**Axit Cacboxylic: Công Thức Chung, Phân Loại, Tính Chất và Ứng Dụng**
Bạn đã bao giờ tự hỏi axit axetic trong giấm hay axit citric trong quả chanh có cấu tạo hóa học như thế nào? Bài viết này của CauHoi2025.EDU.VN sẽ giải đáp tất tần tật về axit cacboxylic, từ công thức chung, cách gọi tên, phân loại, tính chất đến ứng dụng thực tế, giúp bạn hiểu rõ hơn về hợp chất hữu cơ quan trọng này. Cùng khám phá ngay!
1. Axit Cacboxylic Là Gì? Công Thức Chung Của Axit Cacboxylic
Axit cacboxylic là hợp chất hữu cơ mà trong phân tử có chứa nhóm carboxyl (-COOH). Nhóm carboxyl này bao gồm một nhóm carbonyl (C=O) liên kết với một nhóm hydroxyl (-OH). Theo PGS.TS. Nguyễn Hữu Đĩnh, trong cuốn “Hóa học hữu cơ” (Nhà xuất bản Giáo dục Việt Nam, 2010), nhóm carboxyl là nhóm chức quyết định tính chất hóa học đặc trưng của axit cacboxylic.
Công Thức Chung Của Axit Cacboxylic:
- R-COOH hoặc R-CO₂H
Trong đó:
- R là gốc hydrocacbon (alkyl, alkenyl, aryl) hoặc nguyên tử hydro (H).
Ví dụ:
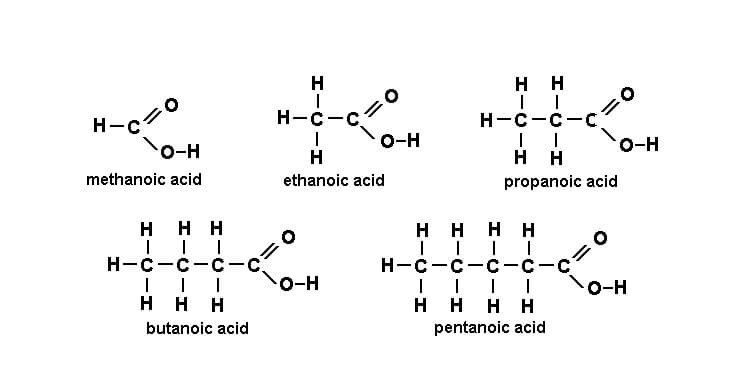
- Axit fomic (HCOOH): R là H
- Axit axetic (CH₃COOH): R là CH₃ (gốc metyl)
- Axit benzoic (C₆H₅COOH): R là C₆H₅ (gốc phenyl)
2. Danh Pháp (Cách Gọi Tên) Của Axit Cacboxylic
Tên gọi của axit cacboxylic có thể theo danh pháp thông thường (tên thường) hoặc danh pháp IUPAC (tên hệ thống).
2.1. Tên Thông Thường (Tên Thường)
Tên thông thường thường xuất phát từ nguồn gốc tìm ra axit đó. Ví dụ, axit fomic (HCOOH) được tìm thấy trong nọc kiến (formica trong tiếng Latinh có nghĩa là kiến), axit axetic (CH₃COOH) có trong giấm (acetum trong tiếng Latinh có nghĩa là giấm).
2.2. Tên IUPAC (Tên Hệ Thống)
Tên IUPAC của axit cacboxylic được hình thành bằng cách thêm hậu tố “-oic” vào tên của hydrocacbon tương ứng với mạch chính chứa nhóm -COOH, sau đó thêm từ “axit” ở đầu. Mạch chính là mạch dài nhất chứa nhóm -COOH.
Quy tắc gọi tên:
- Chọn mạch cacbon dài nhất chứa nhóm -COOH làm mạch chính.
- Đánh số mạch chính bắt đầu từ nguyên tử cacbon của nhóm -COOH (luôn là vị trí số 1).
- Gọi tên theo cấu trúc: axit + tên hydrocacbon tương ứng (mạch chính) + vị trí các nhóm thế (nếu có) + tên các nhóm thế (theo thứ tự bảng chữ cái) + “-oic”.
Ví dụ:
- CH₃COOH: axit etanoic (axit axetic)
- CH₃CH₂COOH: axit propanoic (axit propionic)
- CH₃CH(CH₃)COOH: axit 2-metylpropanoic
2.3. Lưu Ý Quan Trọng
- Đối với axit cacboxylic đa chức (có nhiều nhóm -COOH), sử dụng các tiền tố “di-“, “tri-“, “tetra-“… để chỉ số lượng nhóm -COOH.
- Ví dụ: HOOC-COOH: axit etanedioic (axit oxalic)
- Khi nhóm -COOH gắn trực tiếp vào vòng benzen, tên gọi là “axit benzoic”. Các nhóm thế trên vòng benzen được đánh số và gọi tên tương tự như các hợp chất benzen khác.
- Ví dụ: CH₃-C₆H₄-COOH: axit 4-metylbenzoic
Axit cacboxylic có thể được phân loại dựa trên nhiều tiêu chí khác nhau, bao gồm: Axit cacboxylic thể hiện các tính chất vật lý và hóa học đặc trưng do cấu trúc phân tử của chúng. Tính chất hóa học đặc trưng của axit cacboxylic là tính axit và khả năng tham gia các phản ứng tạo dẫn xuất. Axit cacboxylic là axit yếu, mạnh hơn alcohol nhưng yếu hơn axit vô cơ mạnh như HCl, H₂SO₄. Trong dung dịch nước, axit cacboxylic phân ly một phần tạo thành ion cacboxylat (RCOO⁻) và ion hydroni (H₃O⁺). Tính axit của axit cacboxylic bị ảnh hưởng bởi các nhóm thế trên gốc R. Phản ứng với kim loại hoạt động: Axit cacboxylic phản ứng với kim loại hoạt động (như Na, K, Mg, Al, Zn…) giải phóng khí hydro (H₂). Phản ứng với base: Axit cacboxylic phản ứng với base (như NaOH, KOH, NH₃) tạo thành muối cacboxylat và nước. Phản ứng với muối cacbonat và bicacbonat: Axit cacboxylic phản ứng với muối cacbonat (như Na₂CO₃, K₂CO₃) và bicacbonat (như NaHCO₃, KHCO₃) giải phóng khí cacbon đioxit (CO₂). Phản ứng này được sử dụng để nhận biết axit cacboxylic. Phản ứng este hóa: Axit cacboxylic phản ứng với alcohol tạo thành ester và nước (xúc tác là H₂SO₄ đặc hoặc HCl khan). Đây là phản ứng thuận nghịch. Phản ứng tạo amide: Axit cacboxylic phản ứng với ammonia (NH₃) hoặc amine (R’NH₂, R’₂NH) tạo thành amide và nước. Phản ứng khử: Axit cacboxylic có thể bị khử thành alcohol bậc nhất bằng các chất khử mạnh như LiAlH₄. Phản ứng halogen hóa: Axit cacboxylic có thể tham gia phản ứng halogen hóa α (vị trí cacbon ngay cạnh nhóm -COOH) khi có mặt chất xúc tác là PCl₅ hoặc PBr₃. Để nhận biết axit cacboxylic, có thể sử dụng các phương pháp sau: Lưu ý: Axit fomic (HCOOH) có phản ứng tráng bạc tương tự như aldehyde. Axit cacboxylic có thể được điều chế bằng nhiều phương pháp khác nhau, tùy thuộc vào loại axit và quy mô sản xuất. Oxy hóa alcohol bậc nhất: Alcohol bậc nhất bị oxy hóa bởi các chất oxy hóa mạnh như KMnO₄, K₂Cr₂O₇ tạo thành axit cacboxylic. Oxy hóa aldehyde: Aldehyde bị oxy hóa dễ dàng bởi các chất oxy hóa như KMnO₄, K₂Cr₂O₇ hoặc thậm chí là oxy không khí tạo thành axit cacboxylic. Thủy phân nitrile: Nitrile (RCN) bị thủy phân trong môi trường axit hoặc base tạo thành axit cacboxylic và ammonia. Carboxyl hóa hợp chất Grignard: Hợp chất Grignard (RMgX) phản ứng với CO₂ tạo thành muối cacboxylat, sau đó acid hóa để thu được axit cacboxylic. Lên men giấm: Phương pháp cổ điển để sản xuất axit axetic là lên men ethanol bằng vi khuẩn acetic. Axit cacboxylic có rất nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Độc tính của axit cacboxylic phụ thuộc vào từng loại axit và nồng độ. Một số axit cacboxylic như axit fomic và axit axetic đậm đặc có thể gây bỏng da và ăn mòn. Tuy nhiên, các axit cacboxylic có trong thực phẩm với nồng độ thấp thường an toàn. Tính axit của axit cacboxylic là do sự phân cực của liên kết O-H trong nhóm -COOH. Nguyên tử oxy có độ âm điện lớn hơn nguyên tử hydro, hút electron về phía mình, làm cho liên kết O-H trở nên phân cực. Khi đó, nguyên tử hydro dễ dàng bị tách ra dưới dạng ion H⁺, tạo thành tính axit. Axit cacboxylic, đặc biệt là axit fomic, được sử dụng trong công nghiệp dệt nhuộm để điều chỉnh pH của dung dịch nhuộm, giúp tăng độ bền màu và độ bám dính của thuốc nhuộm lên vải. Axit stearic (C₁₈H₃₆O₂) và axit palmitic (C₁₆H₃₂O₂) là hai axit béo quan trọng được sử dụng để sản xuất xà phòng. Chúng phản ứng với base mạnh (như NaOH hoặc KOH) tạo thành muối natri hoặc kali của axit béo, là thành phần chính của xà phòng. Axit cacboxylic no chỉ chứa liên kết đơn C-C trong gốc hydrocacbon, trong khi axit cacboxylic không no chứa ít nhất một liên kết đôi (C=C) hoặc liên kết ba (C≡C). Axit cacboxylic có thể tác dụng với kim loại hoạt động, base, muối cacbonat, alcohol, ammonia, amine, và các chất khử mạnh. Có thể phân biệt axit cacboxylic với alcohol bằng cách sử dụng giấy quỳ tím (axit cacboxylic làm quỳ tím chuyển đỏ, alcohol thì không), hoặc bằng phản ứng với muối cacbonat (axit cacboxylic tạo khí CO₂, alcohol thì không). Axit cacboxylic đóng vai trò quan trọng trong nhiều quá trình sinh hóa trong cơ thể sống. Ví dụ, axit citric tham gia vào chu trình Krebs (chu trình axit citric), một quá trình quan trọng trong hô hấp tế bào. Các axit béo là thành phần cấu tạo của lipid, đóng vai trò quan trọng trong cấu trúc màng tế bào và cung cấp năng lượng. Một số axit cacboxylic có thể gây ô nhiễm môi trường nếu không được xử lý đúng cách. Ví dụ, axit axetic trong nước thải công nghiệp có thể làm giảm pH của nước, gây ảnh hưởng đến đời sống của các sinh vật thủy sinh. Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về axit cacboxylic. Nếu bạn có bất kỳ thắc mắc nào khác, đừng ngần ngại liên hệ với CAUHOI2025.EDU.VN để được giải đáp tận tình! Bạn đang gặp khó khăn trong việc học hóa hữu cơ? Bạn muốn tìm hiểu sâu hơn về axit cacboxylic và các hợp chất hữu cơ khác? Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá kho tài liệu phong phú, các bài giảng chi tiết và bài tập thực hành đa dạng. Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng hỗ trợ bạn giải đáp mọi thắc mắc và giúp bạn chinh phục môn hóa học một cách dễ dàng! Đừng bỏ lỡ cơ hội nâng cao kiến thức và kỹ năng của bạn. Liên hệ với chúng tôi theo địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội hoặc qua số điện thoại +84 2435162967. Từ khóa LSI: Axit béo, nhóm carboxyl, phản ứng este hóa, axit hữu cơ, tính chất axit. 3. Phân Loại Axit Cacboxylic
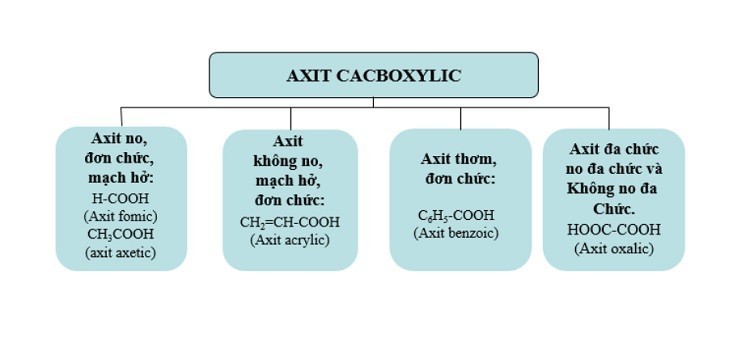
3. Phân Loại Axit Cacboxylic
3.1. Theo Gốc Hydrocacbon
3.2. Theo Số Lượng Nhóm Carboxyl (-COOH)
 4. Tính Chất Của Axit Cacboxylic
4. Tính Chất Của Axit Cacboxylic
4.1. Tính Chất Vật Lý
4.2. Tính Chất Hóa Học
4.2.1. Tính Axit
4.2.2. Phản Ứng Tạo Dẫn Xuất
5. Cách Nhận Biết Axit Cacboxylic
6. Điều Chế Axit Cacboxylic
7. Ứng Dụng Của Axit Cacboxylic Trong Đời Sống và Công Nghiệp
 8. Câu Hỏi Thường Gặp Về Axit Cacboxylic
8. Câu Hỏi Thường Gặp Về Axit Cacboxylic
8.1. Axit cacboxylic có độc không?
8.2. Tại sao axit cacboxylic lại có tính axit?
8.3. Axit cacboxylic có tác dụng gì trong công nghiệp dệt nhuộm?
8.4. Làm thế nào để bảo quản axit cacboxylic an toàn?
8.5. Axit cacboxylic nào được sử dụng để sản xuất xà phòng?
8.6. Sự khác biệt giữa axit cacboxylic no và không no là gì?
8.7. Axit cacboxylic có thể tác dụng với những loại chất nào?
8.8. Làm thế nào để phân biệt axit cacboxylic với alcohol?
8.9. Axit cacboxylic có vai trò gì trong cơ thể sống?
8.10. Axit cacboxylic có ảnh hưởng đến môi trường không?

