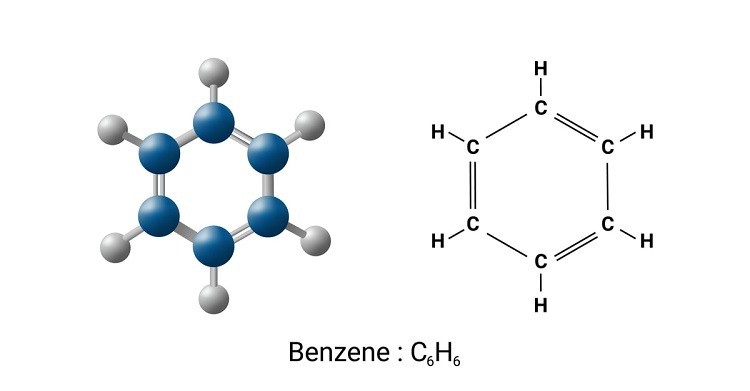
Công Thức Cấu Tạo Benzen: Chi Tiết, Ứng Dụng & Tối Ưu SEO
Benzen là một hợp chất hydrocarbon thơm quen thuộc trong hóa học và công nghiệp. Vậy, Công Thức Cấu Tạo Benzen như thế nào? Ứng dụng của nó trong đời sống ra sao? Hãy cùng CAUHOI2025.EDU.VN khám phá chi tiết về cấu trúc, tính chất và những ứng dụng quan trọng của benzen.
1. Benzen Là Gì?
Benzen là một hợp chất hữu cơ có công thức hóa học là C6H6. Phân tử benzen gồm 6 nguyên tử carbon liên kết với nhau tạo thành một vòng lục giác đều, phẳng. Mỗi nguyên tử carbon liên kết với một nguyên tử hydro.
Theo Wikipedia, benzen là một hydrocarbon thơm mạch vòng no.

Cấu trúc vòng benzen với các liên kết pi luân phiên.
2. Công Thức Cấu Tạo Benzen: Giải Mã Chi Tiết
Công thức cấu tạo benzen là một chủ đề quan trọng trong hóa học hữu cơ. Có nhiều cách để biểu diễn công thức này, mỗi cách thể hiện một khía cạnh khác nhau của cấu trúc phân tử.
2.1. Công Thức Phân Tử và Công Thức Đơn Giản Nhất
- Công thức phân tử: C6H6
- Công thức đơn giản nhất: CH
Công thức phân tử cho biết số lượng nguyên tử của mỗi nguyên tố trong một phân tử benzen. Công thức đơn giản nhất cho biết tỷ lệ tối giản giữa số lượng nguyên tử carbon và hydro.
2.2. Công Thức Cấu Tạo Kekulé
Năm 1865, Friedrich August Kekulé đề xuất cấu trúc vòng cho benzen, trong đó các nguyên tử carbon liên kết với nhau bằng các liên kết đơn và liên kết đôi xen kẽ. Công thức Kekulé là một hình lục giác với các cạnh biểu thị liên kết đơn và liên kết đôi luân phiên.
Tuy nhiên, công thức Kekulé không giải thích được tính chất hóa học đặc biệt của benzen, ví dụ như khả năng tham gia phản ứng thế dễ dàng hơn phản ứng cộng.
2.3. Công Thức Cấu Tạo Hiện Đại
Công thức cấu tạo hiện đại của benzen thể hiện sự giải tỏa electron trong vòng benzen. Thay vì các liên kết đơn và liên kết đôi cố định, các electron pi được phân bố đều trên toàn bộ vòng, tạo thành một hệ thống liên kết pi liên hợp.
Công thức này thường được biểu diễn bằng một hình lục giác với một vòng tròn bên trong, biểu thị sự giải tỏa electron.
2.4. Mô Hình Orbital
Mô hình orbital cung cấp một cái nhìn chi tiết hơn về cấu trúc điện tử của benzen. Sáu nguyên tử carbon trong benzen sử dụng các orbital sp2 để tạo liên kết sigma với các nguyên tử carbon và hydro lân cận. Các orbital p còn lại của mỗi nguyên tử carbon kết hợp với nhau tạo thành một hệ thống các orbital pi phân bố trên toàn bộ vòng.
Hệ thống orbital pi này tạo ra sự ổn định đặc biệt cho phân tử benzen, giải thích tính chất hóa học độc đáo của nó.
3. Tính Chất Vật Lý Của Benzen
Benzen là một chất lỏng không màu, có mùi thơm đặc trưng, dễ bay hơi và dễ cháy. Dưới đây là một số tính chất vật lý quan trọng của benzen:
- Trạng thái: Lỏng
- Màu sắc: Không màu
- Mùi: Thơm đặc trưng
- Khối lượng mol: 78.11 g/mol
- Khối lượng riêng: 0.8765 g/cm³ (ở 20 °C)
- Điểm nóng chảy: 5.5 °C
- Điểm sôi: 80.1 °C
- Độ hòa tan trong nước: Rất ít (1.79 g/L ở 25 °C)
- Độ hòa tan: Tan tốt trong các dung môi hữu cơ như ethanol, ether.
4. Tính Chất Hóa Học Của Benzen
Benzen có những tính chất hóa học đặc trưng do cấu trúc vòng và hệ thống liên kết pi liên hợp. Các phản ứng hóa học quan trọng của benzen bao gồm:
4.1. Phản Ứng Thế Electrophin
Phản ứng thế electrophin là phản ứng đặc trưng của benzen. Trong phản ứng này, một electrophin (tác nhân ưa điện tử) tấn công vòng benzen và thay thế một nguyên tử hydro. Các phản ứng thế electrophin quan trọng bao gồm:
-
Halogen hóa: Benzen phản ứng với halogen (ví dụ: Cl2, Br2) khi có xúc tác là muối sắt (ví dụ: FeCl3, FeBr3) để tạo thành halogenbenzen.
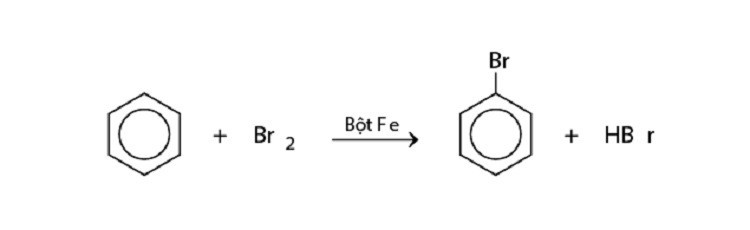
Phản ứng halogen hóa benzen tạo halogenbenzen.
-
Nitro hóa: Benzen phản ứng với hỗn hợp axit nitric đặc và axit sulfuric đặc để tạo thành nitrobenzen.
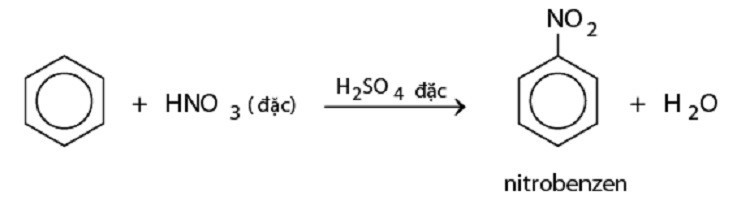
Phản ứng nitro hóa benzen tạo nitrobenzen.
-
Sunfon hóa: Benzen phản ứng với axit sulfuric đặc hoặc oleum (SO3 hòa tan trong H2SO4) để tạo thành axit benzensulfonic.
-
Ankyl hóa Friedel-Crafts: Benzen phản ứng với ankyl halogenua (R-X) khi có xúc tác là axit Lewis (ví dụ: AlCl3) để tạo thành ankylbenzen.
-
Axyl hóa Friedel-Crafts: Benzen phản ứng với axyl halogenua (RCO-X) khi có xúc tác là axit Lewis để tạo thành axylbenzen.
4.2. Phản Ứng Cộng
Benzen khó tham gia phản ứng cộng hơn so với các anken và ankin do tính ổn định của vòng benzen. Tuy nhiên, trong điều kiện khắc nghiệt, benzen vẫn có thể tham gia phản ứng cộng:
-
Cộng hydro: Benzen cộng với hydro khi có xúc tác (ví dụ: Ni, Pt) và nhiệt độ cao để tạo thành xiclohexan.
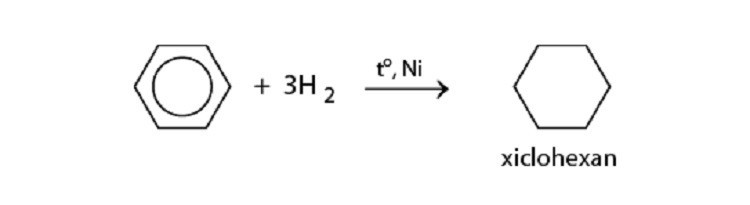
Phản ứng cộng hydro vào vòng benzen tạo xiclohexan.
-
Cộng clo: Benzen cộng với clo khi có ánh sáng tử ngoại để tạo thành hexacloran (C6H6Cl6).
4.3. Phản Ứng Oxi Hóa
Benzen tương đối bền với các chất oxi hóa. Tuy nhiên, khi đốt cháy, benzen cháy trong không khí tạo thành khí CO2 và H2O, đồng thời tỏa nhiều nhiệt.
2C6H6 + 15O2 → 12CO2 + 6H2O
Benzen cũng có thể bị oxi hóa bởi ozon (O3) để tạo thành glyoxal.
5. Điều Chế Benzen
Benzen có thể được điều chế từ nhiều nguồn khác nhau, bao gồm:
-
Từ dầu mỏ: Benzen được tách ra từ phân đoạn xăng nặng của quá trình cracking dầu mỏ hoặc reforming xúc tác.
-
Từ than đá: Benzen được thu hồi từ quá trình cốc hóa than đá.
-
Trime hóa axetilen: Axetilen (C2H2) được trime hóa (kết hợp ba phân tử) ở nhiệt độ cao (600 °C) và có xúc tác là than hoạt tính để tạo thành benzen.
3C2H2 → C6H6
-
Dehydro hóa xiclohexan: Xiclohexan (C6H12) được dehydro hóa (loại bỏ hydro) khi có xúc tác là Pt hoặc Ni và nhiệt độ cao để tạo thành benzen.
C6H12 → C6H6 + 3H2
-
Decarboxyl hóa axit benzoic: Axit benzoic (C6H5COOH) được decarboxyl hóa (loại bỏ CO2) khi đun nóng với vôi tôi xút (NaOH và CaO) để tạo thành benzen.
C6H5COOH + NaOH → C6H6 + Na2CO3
6. Ứng Dụng Của Benzen Trong Đời Sống Và Công Nghiệp
Benzen là một hóa chất công nghiệp quan trọng, được sử dụng rộng rãi làm nguyên liệu để sản xuất nhiều hợp chất khác. Một số ứng dụng quan trọng của benzen bao gồm:
- Sản xuất hóa chất: Benzen là nguyên liệu để sản xuất nhiều hóa chất quan trọng như etylbenzen (để sản xuất stiren), cumen (để sản xuất phenol và axeton), xiclohexan (để sản xuất nylon), nitrobenzen (để sản xuất anilin).
- Dung môi: Benzen được sử dụng làm dung môi trong công nghiệp và phòng thí nghiệm để hòa tan các chất hữu cơ như dầu, mỡ, cao su.
- Sản xuất dược phẩm: Benzen được sử dụng trong sản xuất một số loại thuốc.
- Sản xuất thuốc trừ sâu: Benzen là thành phần trong một số loại thuốc trừ sâu.
- Sản xuất chất dẻo, nhựa, cao su tổng hợp: Benzen được dùng để tổng hợp monome trong sản xuất cao su, chất bôi trơn, polyme dùng cho nhựa, chất tẩy rửa, chất nổ, thuốc trừ sâu và sợi.
- Tăng chỉ số octan của xăng: Benzen được pha vào xăng để tăng chỉ số octan, giúp nhiên liệu đốt cháy hiệu quả hơn.
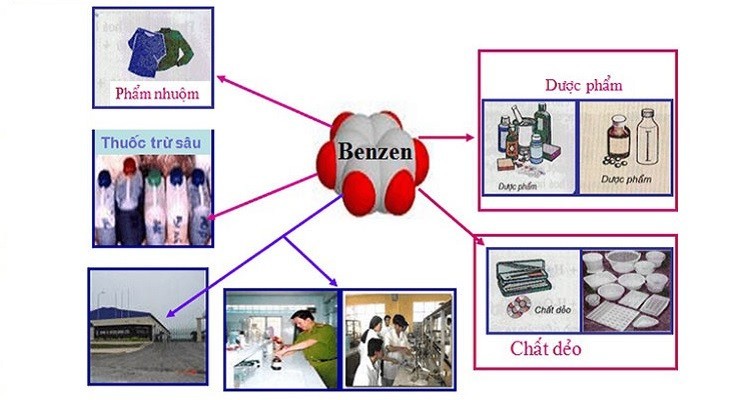
Benzen được sử dụng rộng rãi trong nhiều ngành công nghiệp khác nhau.
7. Tác Hại Của Benzen Đối Với Sức Khỏe
Benzen là một chất độc hại, có thể gây ra nhiều tác hại cho sức khỏe. Tiếp xúc lâu dài với benzen có thể gây ra các bệnh về máu, như thiếu máu, giảm bạch cầu, ung thư máu (leukemia). Benzen cũng có thể gây tổn thương hệ thần kinh, ảnh hưởng đến chức năng gan và thận.
Do độc tính cao, việc sử dụng benzen ngày càng bị hạn chế và thay thế bằng các dung môi khác ít độc hại hơn.
8. Biện Pháp Phòng Ngừa Khi Tiếp Xúc Với Benzen
Để giảm thiểu nguy cơ phơi nhiễm benzen, cần tuân thủ các biện pháp an toàn sau:
- Sử dụng thiết bị bảo hộ cá nhân: Khi làm việc với benzen, cần sử dụng đầy đủ các thiết bị bảo hộ cá nhân như găng tay, kính bảo hộ, khẩu trang, quần áo bảo hộ.
- Đảm bảo thông gió tốt: Làm việc trong môi trường có hệ thống thông gió tốt để giảm nồng độ benzen trong không khí.
- Tránh tiếp xúc trực tiếp: Tránh để benzen tiếp xúc trực tiếp với da và mắt.
- Tuân thủ quy trình an toàn: Tuân thủ nghiêm ngặt các quy trình an toàn khi sử dụng và xử lý benzen.
- Kiểm tra sức khỏe định kỳ: Những người làm việc thường xuyên với benzen nên được kiểm tra sức khỏe định kỳ để phát hiện sớm các dấu hiệu bất thường.
9. Các Câu Hỏi Thường Gặp Về Benzen (FAQ)
Dưới đây là một số câu hỏi thường gặp về benzen:
- Benzen có tan trong nước không?
Benzen tan rất ít trong nước. - Benzen có gây ung thư không?
Có, benzen là một chất gây ung thư. Tiếp xúc lâu dài với benzen có thể gây ra bệnh ung thư máu. - Benzen được sử dụng để làm gì?
Benzen được sử dụng làm nguyên liệu để sản xuất nhiều hóa chất khác, làm dung môi và pha vào xăng để tăng chỉ số octan. - Công thức cấu tạo của benzen là gì?
Công thức cấu tạo của benzen là một vòng lục giác đều với một vòng tròn bên trong, biểu thị sự giải tỏa electron. - Benzen có mùi gì?
Benzen có mùi thơm đặc trưng. - Benzen có dễ cháy không?
Có, benzen là một chất dễ cháy. - Làm thế nào để phòng ngừa phơi nhiễm benzen?
Sử dụng thiết bị bảo hộ cá nhân, đảm bảo thông gió tốt và tuân thủ quy trình an toàn. - Benzen có trong tự nhiên không?
Benzen có thể được tạo ra từ các quá trình tự nhiên như cháy rừng và hoạt động núi lửa. - Benzen có độc không?
Có, benzen là một chất độc hại. - Benzen có thể gây ra những bệnh gì?
Benzen có thể gây ra các bệnh về máu, tổn thương hệ thần kinh, ảnh hưởng đến chức năng gan và thận.
10. Tìm Hiểu Thêm Về Hóa Học Tại CAUHOI2025.EDU.VN
Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về công thức cấu tạo benzen, tính chất và ứng dụng của nó. Nếu bạn có bất kỳ thắc mắc nào khác, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để tìm kiếm câu trả lời và khám phá thêm nhiều kiến thức hóa học thú vị.
Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Các bài viết chi tiết và dễ hiểu về nhiều chủ đề hóa học khác nhau.
- Thông tin được kiểm chứng và cập nhật từ các nguồn uy tín.
- Cộng đồng học tập sôi động, nơi bạn có thể trao đổi kiến thức và đặt câu hỏi.
Hãy để CAUHOI2025.EDU.VN trở thành người bạn đồng hành trên con đường chinh phục tri thức hóa học!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CAUHOI2025.EDU.VN
Đừng quên truy cập CauHoi2025.EDU.VN ngay hôm nay để khám phá thế giới hóa học đầy thú vị và bổ ích!


