Công Thức Biến Thiên Enthalpy: Giải Thích Chi Tiết, Ứng Dụng & Bài Tập
Tìm hiểu chi tiết về Công Thức Biến Thiên Enthalpy, cách tính toán, ý nghĩa của dấu và giá trị, cùng các ví dụ minh họa dễ hiểu. CAUHOI2025.EDU.VN sẽ giúp bạn nắm vững kiến thức này!
1. Biến Thiên Enthalpy Là Gì? Tìm Hiểu Định Nghĩa Chi Tiết
Biến thiên enthalpy (ký hiệu là ΔH) là lượng nhiệt tỏa ra hoặc thu vào của một hệ trong một quá trình hóa học diễn ra ở áp suất không đổi. Đây là một khái niệm quan trọng trong hóa học nhiệt động lực học, giúp chúng ta dự đoán và giải thích các hiện tượng liên quan đến năng lượng trong các phản ứng hóa học. Theo PGS.TS. Nguyễn Văn Nội, Đại học Quốc gia Hà Nội, biến thiên enthalpy là một đại lượng trạng thái, chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối của hệ, không phụ thuộc vào con đường phản ứng.
1.1. Phản Ứng Tỏa Nhiệt và Phản Ứng Thu Nhiệt
Dựa vào dấu của biến thiên enthalpy, ta có thể phân loại phản ứng thành hai loại chính:
-
Phản ứng tỏa nhiệt: Là phản ứng giải phóng nhiệt ra môi trường, làm tăng nhiệt độ của môi trường xung quanh. Đặc trưng của phản ứng tỏa nhiệt là ΔH < 0 (giá trị âm). Ví dụ, phản ứng đốt cháy nhiên liệu, phản ứng trung hòa axit-bazơ.

-
Phản ứng thu nhiệt: Là phản ứng hấp thụ nhiệt từ môi trường, làm giảm nhiệt độ của môi trường xung quanh. Đặc trưng của phản ứng thu nhiệt là ΔH > 0 (giá trị dương). Ví dụ, phản ứng phân hủy muối, phản ứng quang hợp của cây xanh.

1.2. Ý Nghĩa Của Dấu và Giá Trị Biến Thiên Enthalpy
- Dấu của ΔH: Cho biết phản ứng là tỏa nhiệt (ΔH < 0) hay thu nhiệt (ΔH > 0).
- Giá trị tuyệt đối của ΔH: Cho biết lượng nhiệt tỏa ra hoặc thu vào trong quá trình phản ứng. Giá trị ΔH càng lớn (về độ lớn tuyệt đối), lượng nhiệt trao đổi càng nhiều.
Ví dụ: Phản ứng đốt cháy methane (CH₄) có ΔH = -890 kJ/mol. Điều này có nghĩa là khi đốt cháy 1 mol methane, phản ứng tỏa ra 890 kJ nhiệt.
2. Công Thức Tính Biến Thiên Enthalpy: Hai Phương Pháp Phổ Biến
Có hai phương pháp chính để tính biến thiên enthalpy của một phản ứng hóa học:
2.1. Tính Biến Thiên Enthalpy Theo Enthalpy Tạo Thành
Enthalpy tạo thành (hay nhiệt tạo thành) của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn (298 K và 1 bar). Enthalpy tạo thành của đơn chất bền ở điều kiện chuẩn được quy ước bằng 0.
Công thức tính biến thiên enthalpy theo enthalpy tạo thành:
ΔH°rxn = ΣnΔH°f(sản phẩm) – ΣnΔH°f(chất phản ứng)
Trong đó:
- ΔH°rxn: Biến thiên enthalpy chuẩn của phản ứng.
- ΔH°f: Enthalpy tạo thành chuẩn của một chất.
- n: Số mol của chất trong phương trình phản ứng.
- Σ: Tổng.
Ví dụ: Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn ethane (C₂H₆):
2C₂H₆(g) + 7O₂(g) → 4CO₂(g) + 6H₂O(g)
Biết enthalpy tạo thành chuẩn của các chất như sau:
- ΔH°f(CO₂(g)) = -393.5 kJ/mol
- ΔH°f(H₂O(g)) = -241.8 kJ/mol
- ΔH°f(C₂H₆(g)) = -84.7 kJ/mol
- ΔH°f(O₂(g)) = 0 kJ/mol (đơn chất bền)
Áp dụng công thức:
ΔH°rxn = [4ΔH°f(CO₂(g)) + 6ΔH°f(H₂O(g))] – [2ΔH°f(C₂H₆(g)) + 7ΔH°f(O₂(g))]
ΔH°rxn = [4(-393.5) + 6(-241.8)] – [2(-84.7) + 7(0)]
ΔH°rxn = -1574 – 1450.8 + 169.4 = -2855.4 kJ
Vậy, biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane là -2855.4 kJ. Phản ứng này tỏa nhiệt.
2.2. Tính Biến Thiên Enthalpy Theo Năng Lượng Liên Kết
Năng lượng liên kết là năng lượng cần thiết để phá vỡ 1 mol liên kết cộng hóa trị ở thể khí, tạo thành các nguyên tử ở thể khí.
Công thức tính biến thiên enthalpy theo năng lượng liên kết:
ΔH°rxn = ΣE(liên kết bị phá vỡ) – ΣE(liên kết được hình thành)
Trong đó:
- ΔH°rxn: Biến thiên enthalpy chuẩn của phản ứng.
- E: Năng lượng liên kết của một liên kết.
- Σ: Tổng.
Ví dụ: Tính biến thiên enthalpy chuẩn của phản ứng hydro hóa ethylene (C₂H₄):
C₂H₄(g) + H₂(g) → C₂H₆(g)
Biết năng lượng liên kết của các liên kết như sau:
- E(C=C) = 614 kJ/mol
- E(C-H) = 414 kJ/mol
- E(H-H) = 436 kJ/mol
- E(C-C) = 347 kJ/mol
Phân tích:
- Liên kết bị phá vỡ: 1 C=C, 4 C-H, 1 H-H
- Liên kết được hình thành: 1 C-C, 6 C-H
Áp dụng công thức:
ΔH°rxn = [E(C=C) + E(H-H) + 4E(C-H)] – [E(C-C) + 6E(C-H)]
ΔH°rxn = [614 + 436 + 4(414)] – [347 + 6(414)]
ΔH°rxn = 2706 – 2831 = -125 kJ
Vậy, biến thiên enthalpy chuẩn của phản ứng hydro hóa ethylene là -125 kJ. Phản ứng này tỏa nhiệt.
3. Biến Thiên Enthalpy Chuẩn (ΔH°298): Điều Kiện Chuẩn và Ứng Dụng
Biến thiên enthalpy chuẩn (ΔH°298) là biến thiên enthalpy của một phản ứng được đo ở điều kiện chuẩn, tức là ở nhiệt độ 298 K (25°C) và áp suất 1 bar (1 atm).
3.1. Ý Nghĩa của Biến Thiên Enthalpy Chuẩn
- So sánh tính bền của các chất: Các chất có enthalpy tạo thành chuẩn càng âm thì càng bền.
- Dự đoán khả năng xảy ra của phản ứng: Các phản ứng có biến thiên enthalpy chuẩn âm (tỏa nhiệt) thường dễ xảy ra hơn các phản ứng có biến thiên enthalpy chuẩn dương (thu nhiệt). Tuy nhiên, cần lưu ý rằng biến thiên enthalpy chỉ là một yếu tố, còn có các yếu tố khác như entropy và năng lượng tự do Gibbs ảnh hưởng đến khả năng xảy ra của phản ứng.
- Tính toán nhiệt lượng tỏa ra hoặc thu vào của phản ứng ở điều kiện chuẩn: Biến thiên enthalpy chuẩn cho biết lượng nhiệt mà một phản ứng tỏa ra hoặc thu vào khi phản ứng xảy ra hoàn toàn ở điều kiện chuẩn.
3.2. Các Yếu Tố Ảnh Hưởng Đến Biến Thiên Enthalpy
- Nhiệt độ: Biến thiên enthalpy có thể thay đổi theo nhiệt độ.
- Áp suất: Biến thiên enthalpy có thể thay đổi theo áp suất, đặc biệt đối với các phản ứng có sự thay đổi về số mol khí.
- Trạng thái của chất: Biến thiên enthalpy phụ thuộc vào trạng thái của các chất phản ứng và sản phẩm (rắn, lỏng, khí).
- Hệ số tỷ lượng trong phương trình hóa học: Biến thiên enthalpy tỷ lệ thuận với số mol của các chất trong phương trình phản ứng.
4. Bài Tập Vận Dụng Về Công Thức Biến Thiên Enthalpy
Để củng cố kiến thức, chúng ta cùng giải một số bài tập vận dụng:
Bài 1: Cho phản ứng: N₂(g) + 3H₂(g) → 2NH₃(g)
Biết năng lượng liên kết của các liên kết như sau:
- E(N≡N) = 941 kJ/mol
- E(H-H) = 436 kJ/mol
- E(N-H) = 391 kJ/mol
Tính biến thiên enthalpy chuẩn của phản ứng.
Giải:
- Liên kết bị phá vỡ: 1 N≡N, 3 H-H
- Liên kết được hình thành: 6 N-H
Áp dụng công thức:
ΔH°rxn = [E(N≡N) + 3E(H-H)] – [6E(N-H)]
ΔH°rxn = [941 + 3(436)] – [6(391)]
ΔH°rxn = 2249 – 2346 = -97 kJ
Vậy, biến thiên enthalpy chuẩn của phản ứng là -97 kJ. Phản ứng này tỏa nhiệt.
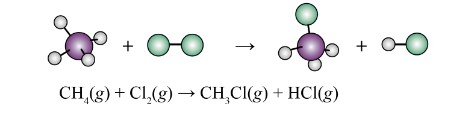
Bài 2: Cho phản ứng: CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(l)
Biết enthalpy tạo thành chuẩn của các chất như sau:
- ΔH°f(CO₂(g)) = -393.5 kJ/mol
- ΔH°f(H₂O(l)) = -285.8 kJ/mol
- ΔH°f(CH₄(g)) = -74.8 kJ/mol
- ΔH°f(O₂(g)) = 0 kJ/mol
Tính biến thiên enthalpy chuẩn của phản ứng.
Giải:
Áp dụng công thức:
ΔH°rxn = [ΔH°f(CO₂(g)) + 2ΔH°f(H₂O(l))] – [ΔH°f(CH₄(g)) + 2ΔH°f(O₂(g))]
ΔH°rxn = [-393.5 + 2(-285.8)] – [-74.8 + 2(0)]
ΔH°rxn = -393.5 – 571.6 + 74.8 = -890.3 kJ
Vậy, biến thiên enthalpy chuẩn của phản ứng là -890.3 kJ. Phản ứng này tỏa nhiệt.
5. Ứng Dụng Thực Tế Của Biến Thiên Enthalpy
Biến thiên enthalpy có nhiều ứng dụng quan trọng trong thực tế, bao gồm:
- Đánh giá hiệu quả của nhiên liệu: Biến thiên enthalpy của phản ứng đốt cháy nhiên liệu cho biết lượng nhiệt mà nhiên liệu đó có thể cung cấp. Nhiên liệu có biến thiên enthalpy càng âm thì càng hiệu quả.
- Thiết kế các quá trình công nghiệp: Biến thiên enthalpy được sử dụng để tính toán nhiệt lượng cần thiết để duy trì nhiệt độ trong các quá trình công nghiệp, giúp tối ưu hóa hiệu quả và tiết kiệm năng lượng.
- Nghiên cứu các phản ứng sinh hóa: Biến thiên enthalpy được sử dụng để nghiên cứu các phản ứng sinh hóa trong cơ thể sống, giúp hiểu rõ hơn về quá trình trao đổi chất và năng lượng.
- Dự báo thời tiết: Biến thiên enthalpy của các quá trình ngưng tụ và bay hơi nước có vai trò quan trọng trong việc hình thành mây, mưa và các hiện tượng thời tiết khác.
6. FAQ – Câu Hỏi Thường Gặp Về Biến Thiên Enthalpy
1. Biến thiên enthalpy có phụ thuộc vào chất xúc tác không?
Không, biến thiên enthalpy là một đại lượng trạng thái, chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối của hệ, không phụ thuộc vào con đường phản ứng hay chất xúc tác.
2. Làm thế nào để xác định một phản ứng là tỏa nhiệt hay thu nhiệt?
Có thể xác định bằng cách đo nhiệt độ của môi trường xung quanh. Nếu nhiệt độ tăng lên, phản ứng là tỏa nhiệt. Nếu nhiệt độ giảm xuống, phản ứng là thu nhiệt. Ngoài ra, có thể dựa vào dấu của biến thiên enthalpy (ΔH < 0: tỏa nhiệt, ΔH > 0: thu nhiệt).
3. Tại sao enthalpy tạo thành của đơn chất bền ở điều kiện chuẩn lại bằng 0?
Vì enthalpy tạo thành là biến thiên enthalpy của phản ứng tạo thành chất đó từ các đơn chất bền nhất. Khi tạo thành một đơn chất từ chính nó, không có sự thay đổi về năng lượng, do đó enthalpy tạo thành bằng 0.
4. Đơn vị của biến thiên enthalpy là gì?
Đơn vị phổ biến của biến thiên enthalpy là kJ/mol (kilojoule trên mol).
5. Sự khác biệt giữa enthalpy và nội năng là gì?
Enthalpy (H) là một hàm nhiệt động lực học được định nghĩa là H = U + pV, trong đó U là nội năng, p là áp suất và V là thể tích. Nội năng (U) là tổng năng lượng của hệ, bao gồm động năng và thế năng của các phân tử. Enthalpy thường được sử dụng để mô tả các quá trình xảy ra ở áp suất không đổi, trong khi nội năng thường được sử dụng cho các quá trình xảy ra ở thể tích không đổi.
6. Biến thiên enthalpy có thể có giá trị bằng 0 không?
Có, biến thiên enthalpy có thể bằng 0 trong một số trường hợp đặc biệt, ví dụ như trong các quá trình chuyển pha ở nhiệt độ và áp suất không đổi.
7. Làm thế nào để tính biến thiên enthalpy của một phản ứng khi không có đủ dữ liệu về enthalpy tạo thành hoặc năng lượng liên kết?
Trong trường hợp này, có thể sử dụng định luật Hess, phát biểu rằng biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối, không phụ thuộc vào con đường phản ứng. Do đó, có thể tính biến thiên enthalpy của phản ứng bằng cách cộng hoặc trừ biến thiên enthalpy của các phản ứng trung gian đã biết.
8. Biến thiên enthalpy có ảnh hưởng đến tốc độ phản ứng không?
Không trực tiếp, nhưng biến thiên enthalpy có thể ảnh hưởng đến hằng số cân bằng của phản ứng, từ đó ảnh hưởng gián tiếp đến tốc độ phản ứng.
9. Biến thiên enthalpy có phải là một đại lượng bảo toàn không?
Không, biến thiên enthalpy không phải là một đại lượng bảo toàn. Nó có thể thay đổi trong quá trình phản ứng hóa học hoặc quá trình vật lý.
10. Làm thế nào để áp dụng kiến thức về biến thiên enthalpy vào thực tế cuộc sống?
Kiến thức về biến thiên enthalpy có thể giúp chúng ta hiểu rõ hơn về các quá trình xảy ra xung quanh, từ việc nấu ăn, sưởi ấm, làm mát cho đến các hiện tượng tự nhiên như mưa, gió, bão. Nó cũng có thể giúp chúng ta đưa ra các quyết định thông minh hơn về việc sử dụng năng lượng và bảo vệ môi trường.
7. CAUHOI2025.EDU.VN – Nguồn Thông Tin Hóa Học Tin Cậy Cho Bạn
Bạn đang gặp khó khăn trong việc học hóa học? Bạn muốn tìm kiếm một nguồn thông tin tin cậy và dễ hiểu? Hãy đến với CAUHOI2025.EDU.VN! Chúng tôi cung cấp các bài viết chi tiết, dễ hiểu về các khái niệm hóa học, cùng với các bài tập vận dụng và lời giải chi tiết. Đặc biệt, đội ngũ chuyên gia của chúng tôi luôn sẵn sàng giải đáp mọi thắc mắc của bạn.
Tại CAUHOI2025.EDU.VN, bạn có thể tìm thấy:
- Giải thích chi tiết về các khái niệm hóa học quan trọng, bao gồm cả công thức biến thiên enthalpy.
- Các ví dụ minh họa dễ hiểu, giúp bạn nắm vững kiến thức.
- Các bài tập vận dụng đa dạng, giúp bạn rèn luyện kỹ năng giải bài tập.
- Diễn đàn hỏi đáp, nơi bạn có thể đặt câu hỏi và nhận được sự hỗ trợ từ các chuyên gia và cộng đồng.
Bạn còn chần chừ gì nữa? Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá thế giới hóa học đầy thú vị!
Để được tư vấn và hỗ trợ tốt nhất, vui lòng liên hệ với CAUHOI2025.EDU.VN theo địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc qua số điện thoại: +84 2435162967. Bạn cũng có thể truy cập trang “Liên hệ” trên website CauHoi2025.EDU.VN để gửi câu hỏi hoặc yêu cầu hỗ trợ.