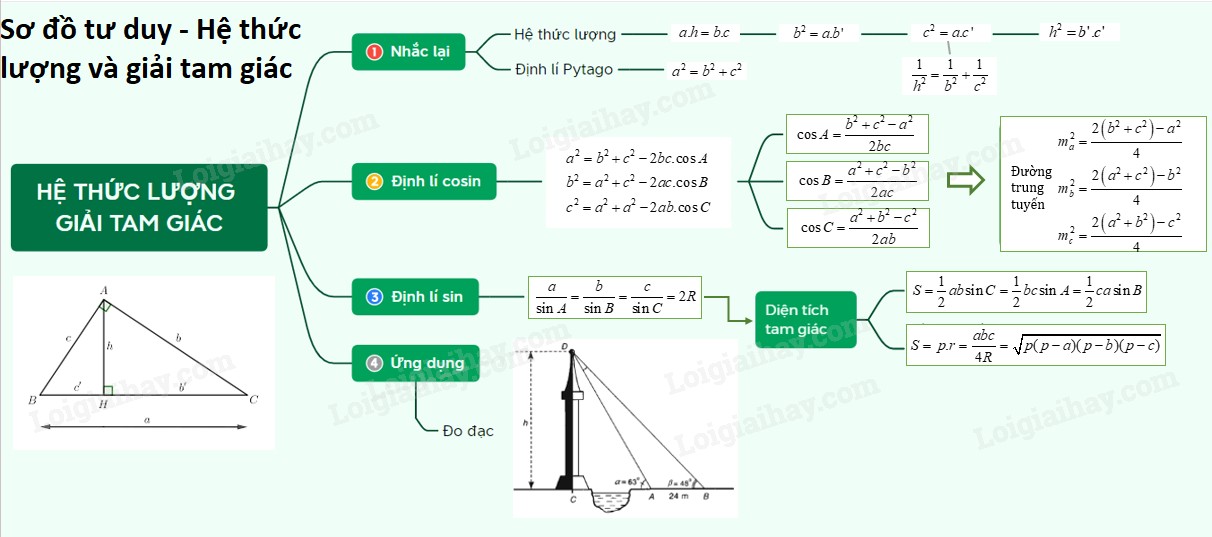
CM = n/V: Công Thức Tính Nồng Độ Mol Chuẩn Xác và Bài Tập Áp Dụng
Việc nắm vững công thức tính nồng độ mol (CM = n/V) là nền tảng quan trọng trong hóa học. Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp kiến thức đầy đủ, chi tiết nhất về công thức này, cùng các ví dụ minh họa và bài tập vận dụng, giúp bạn hiểu sâu và áp dụng hiệu quả.
Giới thiệu: Bạn đang gặp khó khăn với việc tính toán nồng độ mol trong môn Hóa học? Đừng lo lắng! CAUHOI2025.EDU.VN sẽ giúp bạn nắm vững công thức CM = n/V một cách dễ dàng và hiệu quả nhất. Bài viết này không chỉ cung cấp lý thuyết chi tiết mà còn có các ví dụ minh họa và bài tập tự luyện, giúp bạn tự tin giải quyết mọi bài toán liên quan đến nồng độ mol. Chúng tôi cam kết mang đến thông tin chính xác, đáng tin cậy, được trình bày một cách dễ hiểu, giúp bạn tiết kiệm thời gian và đạt kết quả tốt nhất trong học tập.
1. Nồng Độ Mol (CM) Là Gì?
Nồng độ mol, ký hiệu là CM, là một đại lượng biểu thị số mol chất tan có trong một lít dung dịch. Nồng độ mol cho biết mức độ đậm đặc của một chất tan trong dung dịch, từ đó giúp chúng ta định lượng được thành phần của dung dịch.
2. Công Thức Tính Nồng Độ Mol (CM = n/V)
Công thức tính nồng độ mol (CM) là:
CM = n / V
Trong đó:
- CM: Nồng độ mol của dung dịch (đơn vị: mol/L hoặc M).
- n: Số mol của chất tan (đơn vị: mol).
- V: Thể tích của dung dịch (đơn vị: L).
Công thức này thể hiện mối quan hệ trực tiếp giữa nồng độ mol, số mol chất tan và thể tích dung dịch. Khi biết hai trong ba đại lượng này, ta có thể dễ dàng tính được đại lượng còn lại.
3. Các Công Thức Liên Quan Đến Nồng Độ Mol
Ngoài công thức cơ bản CM = n/V, chúng ta còn có một số công thức liên quan khác giúp tính nồng độ mol trong các trường hợp khác nhau:
3.1. Tính Nồng Độ Mol Khi Biết Nồng Độ Phần Trăm và Khối Lượng Riêng
Công thức:
CM = (10 D C%) / M
Trong đó:
- D: Khối lượng riêng của dung dịch (đơn vị: g/mL).
- C%: Nồng độ phần trăm của dung dịch.
- M: Khối lượng mol của chất tan (đơn vị: g/mol).
Công thức này hữu ích khi bạn có thông tin về nồng độ phần trăm và khối lượng riêng của dung dịch, thay vì số mol và thể tích.
3.2. Tính Số Mol Chất Tan (n)
Từ công thức CM = n/V, ta có thể suy ra công thức tính số mol chất tan:
*n = CM V**
Công thức này cho phép bạn tính số mol chất tan cần thiết để pha chế một dung dịch có nồng độ mol mong muốn.
3.3. Tính Thể Tích Dung Dịch (V)
Tương tự, ta cũng có thể suy ra công thức tính thể tích dung dịch:
V = n / CM
Công thức này giúp bạn xác định thể tích dung dịch cần thiết để hòa tan một lượng chất tan nhất định, đạt được nồng độ mol mong muốn.
4. Các Bước Tính Nồng Độ Mol (CM = n/V)
Để tính nồng độ mol một cách chính xác, bạn có thể tuân theo các bước sau:
Bước 1: Xác định số mol chất tan (n).
- Nếu đề bài cho khối lượng chất tan (m) và khối lượng mol của chất tan (M), sử dụng công thức: n = m / M.
- Nếu đề bài cho thể tích khí (V) ở điều kiện tiêu chuẩn (đktc), sử dụng công thức: n = V / 22.4.
- Nếu đề bài cho số phân tử hoặc nguyên tử, sử dụng công thức: n = Số phân tử (hoặc nguyên tử) / 6.022 x 10^23 (Số Avogadro).
Bước 2: Xác định thể tích dung dịch (V) bằng lít.
- Nếu đề bài cho thể tích dung dịch bằng mililit (mL), hãy đổi sang lít bằng cách chia cho 1000: V (L) = V (mL) / 1000.
Bước 3: Áp dụng công thức CM = n / V để tính nồng độ mol.
Bước 4: Kiểm tra lại kết quả và đơn vị.
Đảm bảo rằng bạn đã sử dụng đúng công thức, đơn vị phù hợp và kết quả có vẻ hợp lý.
5. Ví Dụ Minh Họa Cách Tính Nồng Độ Mol (CM = n/V)
Để hiểu rõ hơn về cách áp dụng công thức CM = n/V, hãy cùng xem xét một số ví dụ sau:
Ví dụ 1: Hòa tan 4 gam NaOH vào nước để thu được 200 ml dung dịch. Tính nồng độ mol của dung dịch NaOH.
-
Giải:
-
Bước 1: Tính số mol NaOH.
- Khối lượng mol của NaOH (M) = 23 + 16 + 1 = 40 g/mol.
- Số mol NaOH (n) = m / M = 4 / 40 = 0.1 mol.
-
Bước 2: Đổi thể tích dung dịch sang lít.
- V (L) = 200 mL / 1000 = 0.2 L.
-
Bước 3: Tính nồng độ mol của dung dịch NaOH.
- CM = n / V = 0.1 mol / 0.2 L = 0.5 M.
-
Kết luận: Nồng độ mol của dung dịch NaOH là 0.5 M.
-
Ví dụ 2: Tính số mol HCl có trong 500 ml dung dịch HCl 2M.
-
Giải:
-
Bước 1: Đổi thể tích dung dịch sang lít.
- V (L) = 500 mL / 1000 = 0.5 L.
-
Bước 2: Áp dụng công thức n = CM * V.
- n = 2 M * 0.5 L = 1 mol.
-
Kết luận: Số mol HCl có trong dung dịch là 1 mol.
-
Ví dụ 3: Cần bao nhiêu lít dung dịch NaCl 0.1M để hòa tan hết 5.85 gam NaCl?
-
Giải:
-
Bước 1: Tính số mol NaCl.
- Khối lượng mol của NaCl (M) = 23 + 35.5 = 58.5 g/mol.
- Số mol NaCl (n) = m / M = 5.85 / 58.5 = 0.1 mol.
-
Bước 2: Áp dụng công thức V = n / CM.
- V = 0.1 mol / 0.1 M = 1 L.
-
Kết luận: Cần 1 lít dung dịch NaCl 0.1M để hòa tan hết 5.85 gam NaCl.
-
6. Bài Tập Vận Dụng Tính Nồng Độ Mol (CM = n/V)
Để củng cố kiến thức và rèn luyện kỹ năng giải bài tập về nồng độ mol, hãy thử sức với các bài tập sau:
Bài 1: Hòa tan 10 gam CuSO4 vào nước để được 500 ml dung dịch. Tính nồng độ mol của dung dịch CuSO4.
Bài 2: Tính số mol H2SO4 có trong 250 ml dung dịch H2SO4 0.5M.
Bài 3: Cần bao nhiêu gam KCl để pha chế 1 lít dung dịch KCl 0.2M?
Bài 4: Trộn 300 ml dung dịch NaOH 1M với 200 ml dung dịch NaOH 0.5M. Tính nồng độ mol của dung dịch sau khi trộn (giả sử thể tích dung dịch sau khi trộn bằng tổng thể tích của hai dung dịch ban đầu).
Gợi ý đáp án:
- Bài 1: 0.125M
- Bài 2: 0.125 mol
- Bài 3: 14.9 gam
- Bài 4: 0.8M
7. Ứng Dụng Của Nồng Độ Mol trong Thực Tế
Nồng độ mol là một khái niệm quan trọng và có nhiều ứng dụng trong thực tế, đặc biệt là trong các lĩnh vực sau:
- Hóa học: Tính toán lượng chất tham gia và sản phẩm trong các phản ứng hóa học.
- Sinh học: Pha chế các dung dịch thí nghiệm, chuẩn bị môi trường nuôi cấy tế bào.
- Y học: Tính toán liều lượng thuốc, pha chế dung dịch tiêm truyền.
- Công nghiệp: Kiểm soát chất lượng sản phẩm, điều chỉnh nồng độ các chất trong quá trình sản xuất.
- Nông nghiệp: Pha chế dung dịch phân bón, thuốc trừ sâu.
8. Các Yếu Tố Ảnh Hưởng Đến Nồng Độ Mol
Nồng độ mol của một dung dịch có thể bị ảnh hưởng bởi các yếu tố sau:
- Nhiệt độ: Nhiệt độ tăng có thể làm thay đổi thể tích dung dịch, từ đó ảnh hưởng đến nồng độ mol.
- Áp suất: Áp suất có ảnh hưởng đáng kể đến thể tích của các chất khí, do đó ảnh hưởng đến nồng độ mol của các dung dịch chứa chất khí.
- Sự bay hơi: Sự bay hơi của dung môi có thể làm giảm thể tích dung dịch, dẫn đến tăng nồng độ mol.
- Phản ứng hóa học: Các phản ứng hóa học xảy ra trong dung dịch có thể làm thay đổi số mol chất tan, từ đó ảnh hưởng đến nồng độ mol.
9. Phân Biệt Nồng Độ Mol (CM) và Nồng Độ Molan (Cm)
Nồng độ mol (CM) và nồng độ molan (Cm) là hai khái niệm khác nhau, mặc dù đều liên quan đến nồng độ của dung dịch.
| Đặc điểm | Nồng độ mol (CM) | Nồng độ molan (Cm) |
|---|---|---|
| Định nghĩa | Số mol chất tan trong một lít dung dịch. | Số mol chất tan trong một kilogam dung môi. |
| Công thức | CM = n / V (V là thể tích dung dịch) | Cm = n / m (m là khối lượng dung môi) |
| Đơn vị | mol/L hoặc M | mol/kg |
| Ảnh hưởng bởi T° | Có, vì thể tích dung dịch thay đổi theo nhiệt độ. | Không, vì khối lượng dung môi không đổi theo nhiệt độ. |
| Ứng dụng | Thường dùng trong các phản ứng hóa học trong dung dịch. | Thường dùng trong các nghiên cứu về tính chất của dung dịch. |
Trong nhiều trường hợp, sự khác biệt giữa CM và Cm là không đáng kể, đặc biệt là đối với các dung dịch loãng. Tuy nhiên, khi cần độ chính xác cao hoặc khi nghiên cứu các tính chất của dung dịch ở các nhiệt độ khác nhau, việc phân biệt rõ hai khái niệm này là rất quan trọng.
10. FAQ – Câu Hỏi Thường Gặp Về Nồng Độ Mol (CM = n/V)
1. Nồng độ mol có âm không?
Không, nồng độ mol luôn là một giá trị dương hoặc bằng không, vì nó biểu thị số mol chất tan trong một thể tích dung dịch, và cả hai đại lượng này đều không thể âm.
2. Làm thế nào để pha loãng một dung dịch từ nồng độ mol cao xuống nồng độ mol thấp hơn?
Bạn có thể sử dụng công thức pha loãng: C1V1 = C2V2, trong đó C1 và V1 là nồng độ mol và thể tích ban đầu, C2 và V2 là nồng độ mol và thể tích sau khi pha loãng.
3. Nồng độ mol có thay đổi khi thêm chất tan vào dung dịch không?
Có, nồng độ mol sẽ thay đổi khi bạn thêm chất tan vào dung dịch, vì số mol chất tan đã thay đổi.
4. Nồng độ mol có thay đổi khi thêm dung môi vào dung dịch không?
Có, nồng độ mol sẽ thay đổi khi bạn thêm dung môi vào dung dịch, vì thể tích dung dịch đã thay đổi.
5. Tại sao cần phải biết nồng độ mol của một dung dịch?
Việc biết nồng độ mol của một dung dịch là rất quan trọng trong nhiều lĩnh vực, giúp chúng ta tính toán lượng chất cần thiết cho phản ứng, kiểm soát chất lượng sản phẩm và đảm bảo an toàn trong quá trình sử dụng hóa chất.
6. Đơn vị của nồng độ mol là gì?
Đơn vị của nồng độ mol là mol/L (mol trên lít) hoặc M (Molar).
7. Nồng độ mol và nồng độ phần trăm khác nhau như thế nào?
Nồng độ mol biểu thị số mol chất tan trong một lít dung dịch, trong khi nồng độ phần trăm biểu thị khối lượng chất tan trong 100 gam dung dịch.
8. Làm thế nào để chuyển đổi giữa nồng độ mol và nồng độ phần trăm?
Bạn có thể sử dụng công thức CM = (10 D C%) / M để chuyển đổi giữa hai loại nồng độ này, trong đó D là khối lượng riêng của dung dịch và M là khối lượng mol của chất tan.
9. Nồng độ mol có phụ thuộc vào bản chất của chất tan không?
Có, nồng độ mol phụ thuộc vào bản chất của chất tan, vì khối lượng mol của mỗi chất là khác nhau.
10. Có những loại nồng độ nào khác ngoài nồng độ mol?
Ngoài nồng độ mol, còn có các loại nồng độ khác như nồng độ molan, nồng độ phần trăm, nồng độ đương lượng, v.v.
11. Kết Luận
Nắm vững công thức CM = n/V và các kiến thức liên quan đến nồng độ mol là rất quan trọng trong học tập và ứng dụng hóa học. Hy vọng bài viết này của CAUHOI2025.EDU.VN đã cung cấp cho bạn đầy đủ thông tin và giúp bạn tự tin hơn trong việc giải quyết các bài toán về nồng độ mol.
Bạn còn thắc mắc nào khác về nồng độ mol hay các vấn đề liên quan đến hóa học? Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá kho tàng kiến thức phong phú và nhận được sự hỗ trợ tận tình từ đội ngũ chuyên gia của chúng tôi. Tại CauHoi2025.EDU.VN, bạn sẽ tìm thấy câu trả lời cho mọi thắc mắc, giải pháp cho mọi vấn đề và nguồn cảm hứng để chinh phục đỉnh cao tri thức. Liên hệ với chúng tôi qua địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc số điện thoại +84 2435162967.