CH4 Có Tan Trong Nước Không? Giải Đáp Chi Tiết Từ A-Z
Tìm hiểu xem Ch4 Có Tan Trong Nước Không? CAUHOI2025.EDU.VN sẽ cung cấp câu trả lời chi tiết, dễ hiểu cùng những thông tin hữu ích về khí metan và ứng dụng của nó. Khám phá ngay!
1. CH4 Là Gì? Tổng Quan Về Khí Metan
Khí metan (CH4), còn được gọi là khí bùn ao, là một hợp chất hữu cơ thuộc họ hydrocacbon no (ankan). Metan là thành phần chính của khí tự nhiên, một nguồn năng lượng quan trọng. Khí metan được hình thành từ sự phân hủy kỵ khí của các chất hữu cơ trong môi trường thiếu oxy, ví dụ như trong các đầm lầy, ruộng lúa, và đặc biệt là trong các hầm biogas. Trong công nghiệp, metan có thể được tách chiết từ khí tự nhiên hoặc khí dầu mỏ.
Khí metan có vai trò quan trọng trong nhiều lĩnh vực khác nhau, từ cung cấp năng lượng đến sản xuất hóa chất. Tuy nhiên, metan cũng là một khí nhà kính mạnh, góp phần vào biến đổi khí hậu toàn cầu.
2. CH4 Có Tan Trong Nước Không? Giải Thích Chi Tiết
Vậy, câu hỏi đặt ra là “CH4 có tan trong nước không?” Câu trả lời là không đáng kể. Metan là một phân tử không phân cực, trong khi nước là một dung môi phân cực. “Các chất tương tự hòa tan lẫn nhau” là một nguyên tắc cơ bản trong hóa học, có nghĩa là các chất phân cực dễ hòa tan trong các dung môi phân cực và các chất không phân cực dễ hòa tan trong các dung môi không phân cực. Do đó, metan ít tan trong nước.
2.1. Tại Sao CH4 Ít Tan Trong Nước?
Sở dĩ metan ít tan trong nước là do:
- Tính chất không phân cực: Phân tử metan (CH4) có cấu trúc tứ diện đều, với bốn liên kết C-H phân bố đều xung quanh nguyên tử cacbon trung tâm. Sự phân bố đối xứng này làm cho các moment lưỡng cực của các liên kết C-H triệt tiêu lẫn nhau, dẫn đến phân tử metan không có moment lưỡng cực tổng. Vì vậy, metan là một phân tử không phân cực.
- Liên kết hydro: Nước (H2O) là một phân tử phân cực, có khả năng tạo liên kết hydro mạnh mẽ giữa các phân tử nước với nhau. Để một chất tan trong nước, nó phải có khả năng phá vỡ các liên kết hydro này và tạo ra các tương tác mới với các phân tử nước. Tuy nhiên, metan không có khả năng tạo liên kết hydro với nước, do đó không thể phá vỡ mạng lưới liên kết hydro của nước.
2.2. Độ Tan Của CH4 Trong Nước
Mặc dù metan ít tan trong nước, nhưng vẫn có một lượng nhỏ metan có thể hòa tan trong nước. Độ tan của metan trong nước phụ thuộc vào nhiệt độ và áp suất. Ở điều kiện tiêu chuẩn (0°C và 1 atm), độ tan của metan trong nước là khoảng 22.7 mg/L. Độ tan này tăng lên khi áp suất tăng và giảm xuống khi nhiệt độ tăng.
| Nhiệt độ (°C) | Độ tan của metan trong nước (mg/L) |
|---|---|
| 0 | 22.7 |
| 20 | 18.7 |
| 40 | 15.4 |
| 60 | 12.8 |
Bảng: Độ tan của metan trong nước ở các nhiệt độ khác nhau
2.3. Ứng Dụng Thực Tế Của Độ Tan Của Metan Trong Nước
Mặc dù độ tan của metan trong nước rất nhỏ, nhưng nó vẫn có ý nghĩa quan trọng trong một số ứng dụng thực tế:
- Khai thác khí hydrate: Metan hydrate là một dạng băng chứa metan bị mắc kẹt trong cấu trúc tinh thể của nước. Chúng được tìm thấy trong các trầm tích dưới đáy biển và trong các vùng băng vĩnh cửu. Việc khai thác metan từ metan hydrate là một nguồn năng lượng tiềm năng lớn, nhưng cũng đặt ra nhiều thách thức về mặt kỹ thuật và môi trường.
- Vận chuyển khí tự nhiên: Khí tự nhiên thường được vận chuyển bằng đường ống hoặc bằng tàu chở khí hóa lỏng (LNG). Tuy nhiên, một phần nhỏ khí tự nhiên có thể hòa tan trong nước biển trong quá trình vận chuyển, gây ra ô nhiễm môi trường.
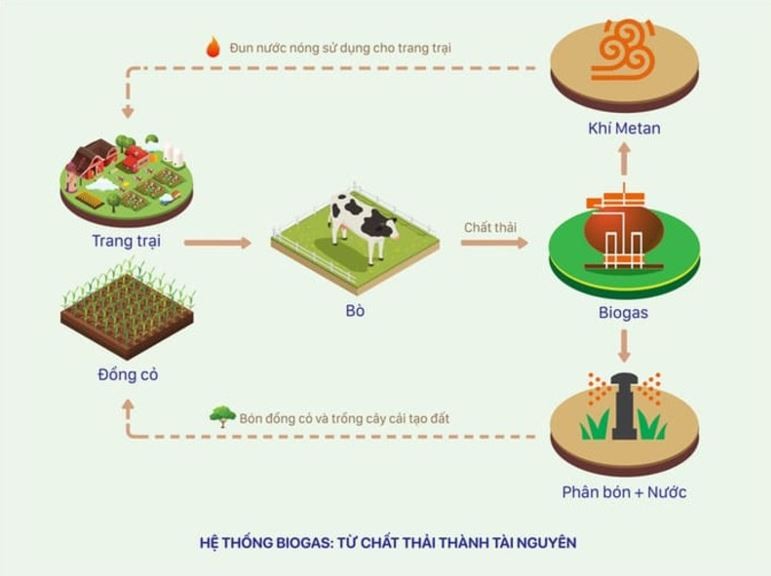
- Hầm Biogas: Như đã đề cập ở trên, metan được tạo ra từ quá trình phân hủy kỵ khí các chất hữu cơ trong hầm biogas. Tuy nhiên, khí metan cần được thu gom và tách khỏi các tạp chất khác để có thể sử dụng hiệu quả.
3. Tính Chất Vật Lý Của Khí Metan
Để hiểu rõ hơn về khả năng hòa tan của metan trong nước, chúng ta hãy cùng tìm hiểu về các tính chất vật lý của khí metan:
- Trạng thái: Ở điều kiện thường, metan là chất khí.
- Màu sắc và mùi: Metan không màu, không mùi. Tuy nhiên, khí tự nhiên thương mại thường được pha thêm một lượng nhỏ chất tạo mùi (như etanethiol) để dễ dàng phát hiện khi có rò rỉ.
- Tỷ trọng: Metan nhẹ hơn không khí (tỷ trọng khoảng 0.55 so với không khí).
- Điểm nóng chảy: -182.5 °C
- Điểm sôi: -161.5 °C
- Độ hòa tan: Ít tan trong nước, tan tốt trong các dung môi hữu cơ.
4. Tính Chất Hóa Học Của Khí Metan
Metan là một chất tương đối trơ ở điều kiện thường, nhưng có thể tham gia vào nhiều phản ứng hóa học quan trọng ở điều kiện thích hợp:
-
Phản ứng cháy: Metan cháy trong không khí tạo ra nhiệt, nước và khí cacbonic (CO2):
CH4 + 2O2 → CO2 + 2H2O + Nhiệt
Phản ứng cháy của metan là một phản ứng tỏa nhiệt mạnh, được sử dụng rộng rãi trong các ứng dụng năng lượng. -
Phản ứng thế halogen: Metan có thể phản ứng với các halogen (như clo, brom) trong điều kiện ánh sáng để tạo ra các dẫn xuất halogen:
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
…
Các dẫn xuất halogen của metan được sử dụng trong nhiều ứng dụng công nghiệp, như làm dung môi, chất làm lạnh, và nguyên liệu sản xuất polyme. -
Phản ứng reforming hơi nước: Metan phản ứng với hơi nước ở nhiệt độ cao và có xúc tác để tạo ra khí tổng hợp (syngas), một hỗn hợp của cacbon monoxit (CO) và hydro (H2):
CH4 + H2O → CO + 3H2
Khí tổng hợp là một nguyên liệu quan trọng để sản xuất nhiều hóa chất khác nhau, như amoniac, metanol, và nhiên liệu tổng hợp. -
Phản ứng cracking: Metan có thể bị cracking (bẻ gãy mạch) ở nhiệt độ cao để tạo ra các olefin (như etylen và propylen) và hydro:
CH4 → C + 2H2
Các olefin là những nguyên liệu quan trọng để sản xuất polyme và các hóa chất khác.
5. Ứng Dụng Của Khí Metan Trong Đời Sống Và Công Nghiệp
Khí metan có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Nhiên liệu: Metan là một nhiên liệu quan trọng, được sử dụng để phát điện, sưởi ấm, và làm nhiên liệu cho các phương tiện giao thông. Khí tự nhiên (chủ yếu là metan) được sử dụng rộng rãi trong các hộ gia đình và các nhà máy điện.
- Nguyên liệu sản xuất hóa chất: Metan là một nguyên liệu quan trọng để sản xuất nhiều hóa chất khác nhau, như amoniac, metanol, formaldehit, axetilen, và các dẫn xuất halogen.
- Sản xuất điện: Metan được đốt trong các nhà máy điện để tạo ra hơi nước, làm quay tuabin và tạo ra điện.
- Sản xuất phân bón: Amoniac, được sản xuất từ metan, là một thành phần quan trọng của phân bón.
- Sản xuất nhựa: Etylen và propylen, được sản xuất từ metan thông qua quá trình cracking, là những nguyên liệu quan trọng để sản xuất nhựa.
- Hầm Biogas: Trong các hệ thống biogas, metan được tạo ra từ quá trình phân hủy kỵ khí các chất thải hữu cơ và được sử dụng làm nhiên liệu.

6. Các Yếu Tố Ảnh Hưởng Đến Quá Trình Hòa Tan Metan Trong Nước
Như đã đề cập ở trên, độ tan của metan trong nước phụ thuộc vào nhiệt độ và áp suất. Ngoài ra, còn có một số yếu tố khác có thể ảnh hưởng đến quá trình hòa tan metan trong nước:
- Sự có mặt của các chất khác: Sự có mặt của các chất khác trong nước, như muối hoặc các chất hữu cơ, có thể làm giảm độ tan của metan. Hiệu ứng này được gọi là hiệu ứng “muối hóa” (salting out).
- pH: pH của nước có thể ảnh hưởng đến độ tan của metan, đặc biệt là khi có mặt các chất có tính axit hoặc bazơ.
- Khuấy trộn: Khuấy trộn có thể làm tăng tốc độ hòa tan của metan trong nước, nhưng không ảnh hưởng đến độ tan cuối cùng.
7. Tác Động Của Khí Metan Đến Môi Trường
Metan là một khí nhà kính mạnh, có khả năng giữ nhiệt cao hơn nhiều so với CO2. Mặc dù nồng độ metan trong khí quyển thấp hơn so với CO2, nhưng metan vẫn đóng góp đáng kể vào biến đổi khí hậu toàn cầu.
7.1. Khí Nhà Kính
Theo báo cáo của Liên Hợp Quốc, metan có tiềm năng làm nóng lên toàn cầu (GWP) gấp 25 lần so với CO2 trong khoảng thời gian 100 năm. Điều này có nghĩa là một tấn metan thải vào khí quyển sẽ gây ra hiệu ứng làm nóng tương đương với 25 tấn CO2 trong vòng 100 năm.
7.2. Nguồn Phát Thải Metan
Các nguồn phát thải metan chính bao gồm:
- Nông nghiệp: Chăn nuôi gia súc (đặc biệt là bò) và trồng lúa nước là những nguồn phát thải metan lớn.
- Khai thác và sản xuất nhiên liệu hóa thạch: Rò rỉ khí tự nhiên trong quá trình khai thác, vận chuyển và sử dụng nhiên liệu hóa thạch là một nguồn phát thải metan quan trọng.
- Xử lý chất thải: Các bãi chôn lấp rác thải và các nhà máy xử lý nước thải là những nguồn phát thải metan đáng kể.
- Đất ngập nước tự nhiên: Các đầm lầy và các vùng đất ngập nước tự nhiên là những nguồn phát thải metan tự nhiên.
7.3. Biện Pháp Giảm Phát Thải Metan
Để giảm thiểu tác động của metan đến biến đổi khí hậu, cần thực hiện các biện pháp giảm phát thải metan từ các nguồn khác nhau:
- Cải thiện phương pháp chăn nuôi: Sử dụng các loại thức ăn phù hợp và cải thiện quản lý chất thải chăn nuôi có thể giảm phát thải metan từ gia súc.
- Giảm rò rỉ khí tự nhiên: Nâng cấp cơ sở hạ tầng và áp dụng các biện pháp kiểm soát rò rỉ trong quá trình khai thác, vận chuyển và sử dụng khí tự nhiên.
- Thu hồi khí metan từ bãi chôn lấp: Thu hồi khí metan từ các bãi chôn lấp rác thải và sử dụng nó làm nhiên liệu.
- Cải thiện quản lý nước thải: Áp dụng các công nghệ xử lý nước thải tiên tiến để giảm phát thải metan.
- Sử dụng năng lượng tái tạo: Thay thế nhiên liệu hóa thạch bằng năng lượng tái tạo (như năng lượng mặt trời, năng lượng gió) để giảm phát thải metan từ quá trình sản xuất năng lượng.
8. Câu Hỏi Thường Gặp (FAQ) Về Khí Metan (CH4)
Dưới đây là một số câu hỏi thường gặp về khí metan:
-
Khí metan có độc không?
- Metan không độc, nhưng có thể gây ngạt nếu nồng độ trong không khí quá cao, làm giảm lượng oxy.
-
Khí metan có gây cháy nổ không?
- Có, metan là một chất dễ cháy và có thể gây nổ nếu hỗn hợp với không khí trong một phạm vi nồng độ nhất định (5-15%).
-
Làm thế nào để phát hiện rò rỉ khí metan?
- Khí metan không mùi, nhưng khí tự nhiên thương mại thường được pha thêm chất tạo mùi để dễ phát hiện rò rỉ. Có thể sử dụng các thiết bị dò khí chuyên dụng để phát hiện rò rỉ metan.
-
Khí metan có ảnh hưởng đến sức khỏe không?
- Tiếp xúc với nồng độ cao metan có thể gây chóng mặt, nhức đầu, buồn nôn và khó thở do thiếu oxy.
-
Ứng dụng quan trọng nhất của khí metan là gì?
- Metan được sử dụng rộng rãi làm nhiên liệu để sưởi ấm, nấu ăn và phát điện. Nó cũng là nguyên liệu quan trọng trong sản xuất hóa chất.
-
Tại sao khí metan lại là một vấn đề môi trường?
- Metan là một khí nhà kính mạnh, góp phần vào biến đổi khí hậu toàn cầu.
-
Làm thế nào để giảm lượng khí metan thải ra từ các hoạt động nông nghiệp?
- Có thể giảm phát thải metan từ nông nghiệp bằng cách cải thiện phương pháp chăn nuôi và quản lý chất thải, cũng như sử dụng các kỹ thuật canh tác bền vững.
-
Khí metan được tạo ra như thế nào trong tự nhiên?
- Metan được tạo ra từ quá trình phân hủy kỵ khí các chất hữu cơ trong môi trường thiếu oxy, như trong đầm lầy, ruộng lúa và hệ tiêu hóa của động vật nhai lại.
-
Khí metan có thể tái tạo được không?
- Khí metan có thể tái tạo được thông qua quá trình phân hủy kỵ khí các chất thải hữu cơ trong các hệ thống biogas.
-
Khí metan có thể thay thế các nguồn năng lượng hóa thạch không?
- Khí metan có thể đóng vai trò quan trọng trong quá trình chuyển đổi sang các nguồn năng lượng sạch hơn, nhưng cần kết hợp với các nguồn năng lượng tái tạo khác để đạt được mục tiêu phát thải ròng bằng không.
9. Kết Luận
Hy vọng bài viết này đã giúp bạn trả lời câu hỏi “CH4 có tan trong nước không” và cung cấp cho bạn những thông tin hữu ích về khí metan. Mặc dù metan ít tan trong nước, nhưng nó vẫn là một hợp chất quan trọng với nhiều ứng dụng trong đời sống và công nghiệp. Tuy nhiên, cần phải quản lý chặt chẽ việc phát thải metan để giảm thiểu tác động tiêu cực đến môi trường.
Nếu bạn có bất kỳ câu hỏi nào khác về khí metan hoặc các vấn đề liên quan đến môi trường, đừng ngần ngại truy cập CauHoi2025.EDU.VN để tìm kiếm thông tin và đặt câu hỏi. Chúng tôi luôn sẵn lòng cung cấp cho bạn những câu trả lời chính xác, đáng tin cậy và dễ hiểu. Liên hệ với chúng tôi tại địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc qua số điện thoại +84 2435162967.

