Cấu Hình Electron Của K (Kali): Chi Tiết, Ứng Dụng Và Bài Tập
Bạn đang tìm hiểu về Cấu Hình Electron Của Kali (K) và những ứng dụng quan trọng của nó trong hóa học? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp cho bạn thông tin chi tiết, dễ hiểu, giúp bạn nắm vững kiến thức và giải quyết các bài tập liên quan một cách hiệu quả.
Giới thiệu
Cấu hình electron là một khái niệm then chốt trong hóa học, giúp ta hiểu rõ hơn về tính chất và vị trí của các nguyên tố trong bảng tuần hoàn. Đặc biệt, cấu hình electron của Kali (K) có nhiều ứng dụng quan trọng trong việc dự đoán tính chất hóa học và khả năng tham gia phản ứng của nguyên tố này. Bài viết này sẽ đi sâu vào cấu hình electron của K, mối liên hệ giữa cấu hình electron và vị trí trong bảng tuần hoàn, cũng như các ví dụ minh họa giúp bạn nắm vững kiến thức.
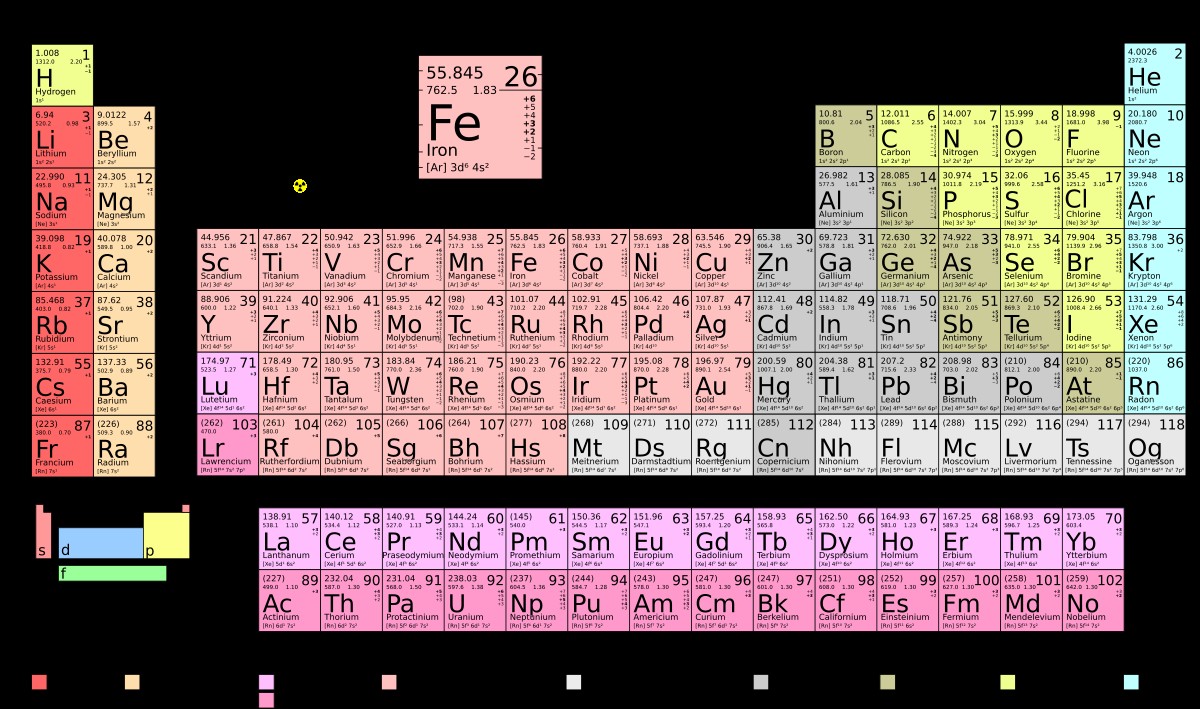
1. Cấu Hình Electron Của Nguyên Tử Kali (Z = 19)
Kali (K) là một nguyên tố hóa học có số hiệu nguyên tử là 19, nghĩa là mỗi nguyên tử K có 19 electron. Vậy, các electron này được phân bố như thế nào trong các lớp và phân lớp electron?
1.1. Xác định cấu hình electron đầy đủ
Để viết cấu hình electron của Kali, ta tuân theo nguyên tắc Aufbau (nguyên tắc sắp xếp electron theo mức năng lượng tăng dần) và quy tắc Hund (nguyên tắc phân bố electron sao cho số electron độc thân là tối đa trong một phân lớp).
Cấu hình electron đầy đủ của Kali là: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
1.2. Viết cấu hình electron rút gọn
Để đơn giản hóa, ta có thể viết cấu hình electron rút gọn của Kali bằng cách sử dụng khí hiếm gần nhất đứng trước Kali trong bảng tuần hoàn, đó là Argon (Ar). Argon có cấu hình electron là 1s² 2s² 2p⁶ 3s² 3p⁶.
Vậy, cấu hình electron rút gọn của Kali là: [Ar] 4s¹
1.3. Ý nghĩa của cấu hình electron
Cấu hình electron cho thấy sự phân bố electron trong các lớp và phân lớp của nguyên tử Kali. Điều này giúp ta hiểu rõ hơn về:
- Số lớp electron: Kali có 4 lớp electron.
- Số electron lớp ngoài cùng: Kali có 1 electron ở lớp ngoài cùng. Electron này quyết định nhiều tính chất hóa học của Kali.
Alt: Mô hình cấu hình electron của nguyên tử Kali với 19 electron.
2. Mối Quan Hệ Giữa Cấu Hình Electron Với Vị Trí Trong Bảng Tuần Hoàn Và Tính Chất Nguyên Tố
Từ cấu hình electron, ta có thể suy ra vị trí của Kali trong bảng tuần hoàn và dự đoán các tính chất hóa học cơ bản của nó.
2.1. Vị trí của Kali trong bảng tuần hoàn
Dựa vào cấu hình electron 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹, ta xác định được:
- Ô số: 19 (do số hiệu nguyên tử Z = 19)
- Chu kỳ: 4 (do có 4 lớp electron)
- Nhóm: IA (do có 1 electron hóa trị, nguyên tố s)
Như vậy, Kali nằm ở ô số 19, chu kỳ 4, nhóm IA trong bảng tuần hoàn.
2.2. Tính chất nguyên tố
-
Kim loại điển hình: Kali thuộc nhóm IA, là nhóm kim loại kiềm, nên Kali là một kim loại điển hình. Theo “Sách giáo khoa Hóa học lớp 10” của Nhà xuất bản Giáo dục Việt Nam, kim loại kiềm có tính khử mạnh, dễ dàng nhường electron trong các phản ứng hóa học.
-
Tính khử mạnh: Do có 1 electron ở lớp ngoài cùng, Kali có xu hướng nhường 1 electron này để đạt cấu hình bền vững của khí hiếm Argon.
K → K⁺ + 1e
Quá trình này thể hiện tính khử mạnh của Kali.
-
Công thức oxit cao nhất: K₂O (là oxit bazơ)
-
Công thức hiđroxit tương ứng: KOH (là bazơ mạnh, còn gọi là potass ăn da). Theo “Hóa học vô cơ” của Đại học Quốc gia Hà Nội, KOH là một bazơ mạnh, được sử dụng rộng rãi trong công nghiệp và phòng thí nghiệm.
3. Ứng Dụng Thực Tế Của Kali
Kali không chỉ là một nguyên tố quan trọng trong hóa học mà còn có nhiều ứng dụng thực tế trong đời sống và công nghiệp.
3.1. Trong nông nghiệp
Kali là một trong ba nguyên tố dinh dưỡng đa lượng thiết yếu cho cây trồng (Nitơ, Phốt pho, Kali). Kali giúp cây trồng:
- Tăng cường khả năng chống chịu sâu bệnh và điều kiện thời tiết bất lợi.
- Thúc đẩy quá trình quang hợp và tổng hợp chất dinh dưỡng.
- Nâng cao chất lượng nông sản.
Các loại phân bón chứa Kali phổ biến bao gồm: KCl (Kali clorua), K₂SO₄ (Kali sulfat).
3.2. Trong y học
Kali đóng vai trò quan trọng trong việc duy trì cân bằng điện giải và hoạt động của hệ thần kinh, cơ bắp. Sự thiếu hụt Kali có thể dẫn đến các vấn đề sức khỏe như:
- Rối loạn nhịp tim.
- Yếu cơ, chuột rút.
- Tăng huyết áp.
Kali được sử dụng trong các loại thuốc bổ sung điện giải và điều trị một số bệnh lý tim mạch.
3.3. Trong công nghiệp
Kali và các hợp chất của nó được sử dụng trong nhiều ngành công nghiệp khác nhau:
- Sản xuất xà phòng: KOH được dùng để sản xuất xà phòng lỏng.
- Sản xuất thủy tinh: Kali cacbonat (K₂CO₃) là một thành phần quan trọng trong sản xuất thủy tinh đặc biệt.
- Sản xuất pin: Kali hydroxit (KOH) được sử dụng làm chất điện ly trong một số loại pin kiềm.
4. Ví Dụ Minh Họa
Để giúp bạn hiểu rõ hơn về cấu hình electron của Kali và ứng dụng của nó, chúng ta hãy cùng xem xét một số ví dụ sau:
Câu 1: Nguyên tố X thuộc nhóm IA và nguyên tử X có tổng số electron phân lớp s là 7. Cấu hình electron của X là
A. [Ne]3s¹
B. [Ne]3s²
C. [Ar]4s¹
D. [Ar]4s²
Lời giải:
Đáp án C
Nguyên tố X thuộc nhóm IA nên cấu hình electron lớp ngoài cùng là ns¹.
Nguyên tử X có tổng số electron phân lớp s là 7.
→ Cấu hình electron của X là 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ hay [Ar]4s¹.
Câu 2: Cation R⁺ có tổng số hạt là 57, số hạt mang điện nhiều hơn số hạt không mang điện là 17 hạt. Vị trí của nguyên tố R trong bảng tuần hoàn hóa học?
A. Ô 19, chu kỳ 3, nhóm IA.
B. Ô 11, chu kỳ 2, nhóm IA.
C. Ô 19, chu kỳ 4, nhóm IA.
D. Ô 11, chu kỳ 3, nhóm IA.
Lời giải:
Đáp án C
Gọi số hạt electron, proton, neutron là e, p, n.
Ta có: e = p (do nguyên tử trung hòa về điện)
R → R⁺ + e
Cation R⁺ có tổng số hạt là 57 → (e – 1) + p + n = 57 hay 2p + n = 58 (1)
Trong cation, số hạt mang điện nhiều hơn số hạt không mang điện là 17 hạt.
→ (e – 1) + p = n + 17 hay 2p – n = 18 (2)
Từ (1) và (2) → e = p = 19 và n = 20
→ Cấu hình electron của R là 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹.
→ Nguyên tử R có 19 electron phân bố trên 4 lớp electron và có 1 electron lớp ngoài cùng.
→ Nguyên tố R thuộc ô 19, chu kỳ 4, nhóm IA.

5. Các Dạng Bài Tập Thường Gặp Về Cấu Hình Electron Của Kali
Khi học về cấu hình electron của Kali, bạn có thể gặp các dạng bài tập sau:
- Viết cấu hình electron: Yêu cầu viết cấu hình electron đầy đủ hoặc rút gọn của Kali.
- Xác định vị trí trong bảng tuần hoàn: Dựa vào cấu hình electron để xác định vị trí của Kali trong bảng tuần hoàn (ô, chu kỳ, nhóm).
- Dự đoán tính chất hóa học: Dựa vào cấu hình electron để dự đoán tính chất hóa học cơ bản của Kali (tính kim loại, tính khử, khả năng tạo hợp chất).
- Bài tập tổng hợp: Kết hợp các kiến thức về cấu hình electron, vị trí trong bảng tuần hoàn và tính chất hóa học để giải các bài tập phức tạp hơn.
Để làm tốt các dạng bài tập này, bạn cần nắm vững các nguyên tắc viết cấu hình electron, mối liên hệ giữa cấu hình electron và vị trí trong bảng tuần hoàn, cũng như các tính chất hóa học đặc trưng của kim loại kiềm.
6. Mẹo Học Hiệu Quả Về Cấu Hình Electron
Để học tốt về cấu hình electron nói chung và cấu hình electron của Kali nói riêng, bạn có thể áp dụng một số mẹo sau:
- Học thuộc lòng các nguyên tắc cơ bản: Nguyên tắc Aufbau, quy tắc Hund, quy tắc Klechkowski.
- Luyện tập viết cấu hình electron thường xuyên: Bắt đầu với các nguyên tố đơn giản, sau đó chuyển sang các nguyên tố phức tạp hơn.
- Sử dụng bảng tuần hoàn một cách hiệu quả: Bảng tuần hoàn là một công cụ hữu ích giúp bạn xác định vị trí của các nguyên tố và dự đoán cấu hình electron của chúng.
- Liên hệ kiến thức với thực tế: Tìm hiểu về các ứng dụng thực tế của Kali và các hợp chất của nó để tăng hứng thú học tập.
- Tìm kiếm sự giúp đỡ khi cần thiết: Đừng ngần ngại hỏi thầy cô, bạn bè hoặc tìm kiếm thông tin trên các trang web uy tín như CAUHOI2025.EDU.VN khi gặp khó khăn.
7. Câu Hỏi Thường Gặp (FAQ) Về Cấu Hình Electron Của Kali
Câu 1: Tại sao Kali lại có tính khử mạnh?
Kali có tính khử mạnh vì nó dễ dàng nhường 1 electron ở lớp ngoài cùng để đạt cấu hình bền vững của khí hiếm Argon.
Câu 2: Kali có tác dụng gì đối với cây trồng?
Kali giúp cây trồng tăng cường khả năng chống chịu sâu bệnh, thúc đẩy quá trình quang hợp và tổng hợp chất dinh dưỡng, nâng cao chất lượng nông sản.
Câu 3: Kali được sử dụng trong những ngành công nghiệp nào?
Kali được sử dụng trong sản xuất xà phòng, sản xuất thủy tinh, sản xuất pin và nhiều ngành công nghiệp khác.
Câu 4: Cấu hình electron rút gọn của Kali là gì?
Cấu hình electron rút gọn của Kali là [Ar] 4s¹.
Câu 5: Kali nằm ở vị trí nào trong bảng tuần hoàn?
Kali nằm ở ô số 19, chu kỳ 4, nhóm IA trong bảng tuần hoàn.
Câu 6: Công thức oxit cao nhất của Kali là gì?
Công thức oxit cao nhất của Kali là K₂O.
Câu 7: Công thức hiđroxit tương ứng của Kali là gì?
Công thức hiđroxit tương ứng của Kali là KOH.
Câu 8: Thiếu Kali có thể gây ra những vấn đề sức khỏe nào?
Thiếu Kali có thể gây ra rối loạn nhịp tim, yếu cơ, chuột rút, tăng huyết áp.
Câu 9: Phân bón chứa Kali có những loại nào?
Các loại phân bón chứa Kali phổ biến bao gồm: KCl (Kali clorua), K₂SO₄ (Kali sulfat).
Câu 10: Tại sao cần học về cấu hình electron của Kali?
Học về cấu hình electron của Kali giúp ta hiểu rõ hơn về tính chất hóa học, vị trí trong bảng tuần hoàn và ứng dụng của nguyên tố này trong đời sống và công nghiệp.
Kết luận
Hy vọng bài viết này của CAUHOI2025.EDU.VN đã cung cấp cho bạn đầy đủ thông tin và kiến thức cần thiết về cấu hình electron của Kali. Nắm vững kiến thức này sẽ giúp bạn học tốt môn Hóa học và ứng dụng nó vào thực tế một cách hiệu quả.
Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để tìm kiếm câu trả lời hoặc đặt câu hỏi trực tiếp cho đội ngũ chuyên gia của chúng tôi. Chúng tôi luôn sẵn lòng hỗ trợ bạn trên con đường chinh phục kiến thức!
Bạn muốn tìm hiểu sâu hơn về các nguyên tố hóa học khác? Hãy truy cập ngay CAUHOI2025.EDU.VN để khám phá kho tàng kiến thức hóa học phong phú và đa dạng!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN