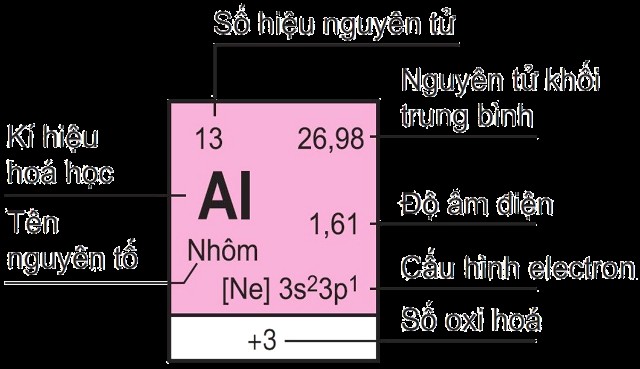
**Cách Phân Biệt Liên Kết Ion và Liên Kết Cộng Hóa Trị Chi Tiết Nhất 2024?**
Bạn đang gặp khó khăn trong việc phân biệt liên kết ion và liên kết cộng hóa trị? CAUHOI2025.EDU.VN sẽ giúp bạn giải đáp thắc mắc này một cách chi tiết và dễ hiểu nhất. Bài viết này sẽ cung cấp cho bạn kiến thức toàn diện về hai loại liên kết hóa học quan trọng này, giúp bạn nắm vững bản chất và ứng dụng của chúng. Cùng CAUHOI2025.EDU.VN khám phá ngay!
1. Ý Định Tìm Kiếm của Người Dùng
Trước khi đi sâu vào chi tiết, hãy cùng xác định những gì người dùng thường tìm kiếm khi quan tâm đến “Cách Phân Biệt Liên Kết Ion Và Liên Kết Cộng Hóa Trị”:
- Định nghĩa và bản chất: Người dùng muốn hiểu rõ định nghĩa, đặc điểm cơ bản của cả hai loại liên kết.
- Sự hình thành: Quá trình hình thành liên kết ion và liên kết cộng hóa trị diễn ra như thế nào?
- Tính chất vật lý và hóa học: Liên kết ion và liên kết cộng hóa trị ảnh hưởng đến tính chất của chất như thế nào?
- Ví dụ minh họa: Các ví dụ cụ thể về các chất có liên kết ion và liên kết cộng hóa trị.
- Cách nhận biết: Làm thế nào để phân biệt hai loại liên kết này trong một hợp chất cụ thể?
2. Liên Kết Cộng Hóa Trị Là Gì?
Liên kết cộng hóa trị là liên kết hóa học được hình thành khi hai hoặc nhiều nguyên tử chia sẻ các electron hóa trị để đạt được cấu hình electron bền vững. Nói một cách đơn giản, đó là sự “góp chung” electron giữa các nguyên tử.
2.1. Sự Hình Thành Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị thường hình thành giữa các phi kim với nhau. Các nguyên tử phi kim có xu hướng hút electron để đạt được cấu hình bền vững của khí hiếm. Thay vì nhường hoặc nhận electron hoàn toàn, chúng chia sẻ electron để cùng đạt được mục tiêu này.
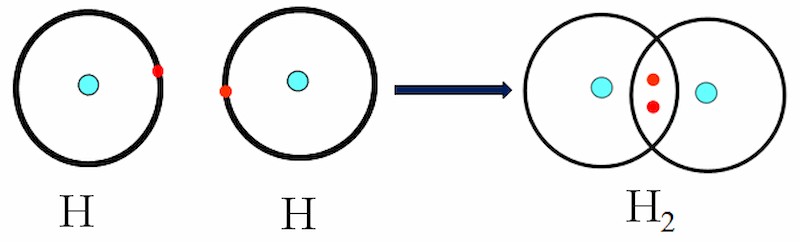
Ví dụ, phân tử Hydro (H₂) được hình thành khi hai nguyên tử Hydro chia sẻ hai electron để tạo thành một cặp electron chung. Mỗi nguyên tử Hydro, ban đầu chỉ có một electron, giờ đây có hai electron trong lớp vỏ ngoài cùng, tương tự như cấu hình của khí hiếm Heli.

2.2. Các Loại Liên Kết Cộng Hóa Trị
- Liên kết đơn: Hình thành khi hai nguyên tử chia sẻ một cặp electron. Ví dụ: H-H trong phân tử Hydro.
- Liên kết đôi: Hình thành khi hai nguyên tử chia sẻ hai cặp electron. Ví dụ: O=O trong phân tử Oxy.
- Liên kết ba: Hình thành khi hai nguyên tử chia sẻ ba cặp electron. Ví dụ: N≡N trong phân tử Nitơ.
2.3. Liên Kết Cộng Hóa Trị Phân Cực và Không Phân Cực
- Liên kết cộng hóa trị không phân cực: Xảy ra khi các electron được chia sẻ đều giữa hai nguyên tử. Điều này thường xảy ra khi hai nguyên tử giống nhau hoặc có độ âm điện tương đương. Ví dụ: H-H, O=O, Cl-Cl.
- Liên kết cộng hóa trị phân cực: Xảy ra khi các electron được chia sẻ không đều giữa hai nguyên tử. Điều này xảy ra khi một nguyên tử có độ âm điện lớn hơn nguyên tử kia. Nguyên tử có độ âm điện lớn hơn sẽ hút electron mạnh hơn, tạo ra một phần điện tích âm (δ-) trên nguyên tử đó và một phần điện tích dương (δ+) trên nguyên tử còn lại. Ví dụ: H-Cl, H-O.
Trong phân tử HCl, Clo có độ âm điện lớn hơn Hydro, do đó cặp electron chung bị hút lệch về phía Clo, tạo ra một liên kết phân cực.

2.4. Tính Chất của Các Chất Cộng Hóa Trị
Các chất cộng hóa trị thường có các tính chất sau:
- Trạng thái: Có thể tồn tại ở trạng thái rắn, lỏng hoặc khí ở điều kiện thường.
- Điểm nóng chảy và điểm sôi: Thường thấp hơn so với các chất ion.
- Độ tan: Độ tan phụ thuộc vào độ phân cực của phân tử và dung môi. Các chất phân cực thường tan tốt trong dung môi phân cực (như nước), trong khi các chất không phân cực thường tan tốt trong dung môi không phân cực (như benzen).
- Độ dẫn điện: Thường không dẫn điện ở trạng thái rắn hoặc lỏng, vì không có các ion hoặc electron tự do di chuyển.
3. Liên Kết Ion Là Gì?
Liên kết ion là liên kết hóa học được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Liên kết ion xảy ra khi một hoặc nhiều electron được chuyển hoàn toàn từ một nguyên tử sang nguyên tử khác.
3.1. Sự Hình Thành Liên Kết Ion
Liên kết ion thường hình thành giữa một kim loại và một phi kim. Kim loại có xu hướng nhường electron để trở thành ion dương (cation), trong khi phi kim có xu hướng nhận electron để trở thành ion âm (anion).
Ví dụ, Natri (Na) là một kim loại dễ dàng nhường một electron để trở thành ion Na⁺. Clo (Cl) là một phi kim dễ dàng nhận một electron để trở thành ion Cl⁻. Khi Natri và Clo phản ứng với nhau, Natri nhường electron cho Clo, tạo thành các ion Na⁺ và Cl⁻. Lực hút tĩnh điện giữa các ion này tạo thành liên kết ion trong hợp chất Natri Clorua (NaCl), hay còn gọi là muối ăn.
3.2. Tính Chất của Các Chất Ion
Các chất ion thường có các tính chất sau:
- Trạng thái: Thường tồn tại ở trạng thái rắn ở điều kiện thường.
- Điểm nóng chảy và điểm sôi: Thường cao do lực hút tĩnh điện mạnh giữa các ion.
- Độ tan: Nhiều chất ion tan tốt trong dung môi phân cực như nước, vì các phân tử nước có thể tương tác với các ion và làm giảm lực hút giữa chúng.
- Độ dẫn điện: Không dẫn điện ở trạng thái rắn, vì các ion bị cố định trong mạng lưới tinh thể. Tuy nhiên, chúng dẫn điện khi nóng chảy hoặc hòa tan trong nước, vì các ion có thể di chuyển tự do.
4. Bảng So Sánh Chi Tiết Liên Kết Ion và Liên Kết Cộng Hóa Trị
Để giúp bạn dễ dàng phân biệt, dưới đây là bảng so sánh chi tiết các đặc điểm của liên kết ion và liên kết cộng hóa trị:
| Đặc điểm | Liên kết ion | Liên kết cộng hóa trị |
|---|---|---|
| Bản chất | Lực hút tĩnh điện giữa các ion trái dấu | Chia sẻ electron giữa các nguyên tử |
| Sự hình thành | Chuyển electron từ kim loại sang phi kim | Chia sẻ electron giữa các phi kim |
| Loại nguyên tố | Kim loại và phi kim | Phi kim và phi kim |
| Độ âm điện | Chênh lệch độ âm điện lớn (thường > 1.7) | Chênh lệch độ âm điện nhỏ (thường < 1.7) |
| Trạng thái | Rắn ở điều kiện thường | Rắn, lỏng hoặc khí ở điều kiện thường |
| Điểm nóng chảy/sôi | Cao | Thường thấp |
| Độ tan | Thường tan tốt trong dung môi phân cực (như nước) | Độ tan phụ thuộc vào độ phân cực (tan tốt trong dung môi tương ứng) |
| Độ dẫn điện | Dẫn điện khi nóng chảy hoặc hòa tan trong nước | Thường không dẫn điện |
| Ví dụ | NaCl, KCl, MgO | H₂O, CO₂, CH₄ |
5. Mối Liên Hệ Giữa Liên Kết Ion và Liên Kết Cộng Hóa Trị
Cần lưu ý rằng, trên thực tế, không có liên kết nào là hoàn toàn ion hoặc hoàn toàn cộng hóa trị. Hầu hết các liên kết đều có tính chất trung gian giữa hai loại này. Mức độ ion hay cộng hóa trị của một liên kết phụ thuộc vào độ chênh lệch độ âm điện giữa các nguyên tử tham gia liên kết.
- Nếu độ chênh lệch độ âm điện rất lớn, liên kết có tính ion cao.
- Nếu độ chênh lệch độ âm điện nhỏ, liên kết có tính cộng hóa trị cao.
Theo PGS.TS Nguyễn Văn Nội, giảng viên cao cấp tại Đại học Sư phạm Hà Nội, có một số trường hợp đặc biệt mà một hợp chất có thể chứa cả liên kết ion và liên kết cộng hóa trị. Ví dụ, trong hợp chất NaOH (Natri hydroxit), liên kết giữa Na⁺ và nhóm OH⁻ là liên kết ion, trong khi liên kết giữa O và H trong nhóm OH⁻ là liên kết cộng hóa trị.
6. Cách Nhận Biết Liên Kết Ion và Liên Kết Cộng Hóa Trị
Dưới đây là một số cách để nhận biết liên kết ion và liên kết cộng hóa trị trong một hợp chất:
- Dựa vào loại nguyên tố: Nếu hợp chất được tạo thành từ một kim loại và một phi kim, khả năng cao là nó có liên kết ion. Nếu hợp chất được tạo thành từ các phi kim, khả năng cao là nó có liên kết cộng hóa trị.
- Dựa vào độ âm điện: Tính độ chênh lệch độ âm điện giữa các nguyên tử tham gia liên kết. Nếu độ chênh lệch lớn (thường > 1.7), liên kết có tính ion cao. Nếu độ chênh lệch nhỏ (thường < 1.7), liên kết có tính cộng hóa trị cao. Bạn có thể tham khảo bảng độ âm điện của các nguyên tố hóa học.
- Dựa vào tính chất vật lý: Nếu chất có điểm nóng chảy và điểm sôi cao, dẫn điện khi nóng chảy hoặc hòa tan trong nước, khả năng cao là nó có liên kết ion. Nếu chất có điểm nóng chảy và điểm sôi thấp, không dẫn điện, khả năng cao là nó có liên kết cộng hóa trị.
7. Bài Tập Vận Dụng
Để củng cố kiến thức, hãy cùng làm một số bài tập vận dụng sau:
- Xác định loại liên kết trong các hợp chất sau: KCl, H₂S, MgO, CH₄, NH₃.
- Sắp xếp các chất sau theo chiều tăng dần độ phân cực của liên kết: H₂O, HF, HBr, HCl.
- Giải thích tại sao NaCl có điểm nóng chảy cao hơn H₂O.
Gợi ý đáp án:
- KCl (ion), H₂S (cộng hóa trị phân cực), MgO (ion), CH₄ (cộng hóa trị không phân cực), NH₃ (cộng hóa trị phân cực).
- HBr < HCl < H₂O < HF.
- NaCl là hợp chất ion, có lực hút tĩnh điện mạnh giữa các ion, cần nhiều năng lượng để phá vỡ liên kết. H₂O là hợp chất cộng hóa trị phân cực, có lực tương tác yếu hơn giữa các phân tử.
8. FAQ – Câu Hỏi Thường Gặp
Câu 1: Liên kết kim loại là gì và nó khác với liên kết ion và liên kết cộng hóa trị như thế nào?
Liên kết kim loại là loại liên kết được hình thành giữa các nguyên tử kim loại. Trong liên kết kim loại, các electron hóa trị di chuyển tự do giữa các nguyên tử, tạo thành một “biển electron” bao quanh các ion kim loại dương. Liên kết kim loại khác với liên kết ion và liên kết cộng hóa trị ở chỗ các electron không được chuyển giao (như liên kết ion) hoặc chia sẻ (như liên kết cộng hóa trị) giữa các nguyên tử cụ thể, mà di chuyển tự do trong toàn bộ cấu trúc kim loại.
Câu 2: Có phải tất cả các hợp chất ion đều tan trong nước?
Không, không phải tất cả các hợp chất ion đều tan trong nước. Độ tan của một hợp chất ion phụ thuộc vào sự cân bằng giữa năng lượng mạng lưới tinh thể (năng lượng cần thiết để phá vỡ mạng lưới tinh thể) và năng lượng hydrat hóa (năng lượng giải phóng khi các ion tương tác với các phân tử nước). Nếu năng lượng hydrat hóa lớn hơn năng lượng mạng lưới, hợp chất sẽ tan trong nước.
Câu 3: Tại sao các chất cộng hóa trị thường có điểm nóng chảy và điểm sôi thấp hơn các chất ion?
Các chất cộng hóa trị có điểm nóng chảy và điểm sôi thấp hơn vì lực tương tác giữa các phân tử cộng hóa trị yếu hơn lực hút tĩnh điện giữa các ion trong hợp chất ion. Lực tương tác giữa các phân tử cộng hóa trị có thể là lực Van der Waals (lực hút lưỡng cực-lưỡng cực, lực London) hoặc liên kết hydro (trong các phân tử có chứa H liên kết với O, N, F).
Câu 4: Làm thế nào để xác định độ phân cực của một phân tử?
Độ phân cực của một phân tử phụ thuộc vào độ phân cực của các liên kết trong phân tử và hình dạng của phân tử. Nếu một phân tử có các liên kết phân cực và hình dạng của nó không đối xứng, phân tử đó sẽ phân cực. Nếu một phân tử có các liên kết phân cực nhưng hình dạng của nó đối xứng, các độ phân cực liên kết có thể triệt tiêu lẫn nhau, và phân tử đó sẽ không phân cực.
Câu 5: Liên kết hydro là gì và nó có phải là một loại liên kết cộng hóa trị không?
Liên kết hydro là một loại lực hút giữa một nguyên tử hydro liên kết với một nguyên tử có độ âm điện cao (như O, N, F) và một nguyên tử có độ âm điện cao khác. Liên kết hydro không phải là một loại liên kết cộng hóa trị, mà là một loại lực tương tác giữa các phân tử. Nó mạnh hơn các lực Van der Waals nhưng yếu hơn liên kết cộng hóa trị hoặc liên kết ion.
Câu 6: Các yếu tố nào ảnh hưởng đến độ mạnh của liên kết cộng hóa trị?
Độ mạnh của liên kết cộng hóa trị phụ thuộc vào nhiều yếu tố, bao gồm:
- Độ dài liên kết: Liên kết càng ngắn, càng mạnh.
- Số lượng electron được chia sẻ: Liên kết ba mạnh hơn liên kết đôi, liên kết đôi mạnh hơn liên kết đơn.
- Độ phân cực của liên kết: Liên kết phân cực thường mạnh hơn liên kết không phân cực.
Câu 7: Làm thế nào để viết công thức Lewis cho các phân tử cộng hóa trị?
Để viết công thức Lewis cho các phân tử cộng hóa trị, bạn cần thực hiện các bước sau:
- Tính tổng số electron hóa trị của tất cả các nguyên tử trong phân tử.
- Vẽ cấu trúc khung của phân tử, với các nguyên tử liên kết với nhau bằng các liên kết đơn.
- Phân phối các electron còn lại thành các cặp electron cô đơn xung quanh các nguyên tử để thỏa mãn quy tắc octet (8 electron) cho mỗi nguyên tử (trừ Hydro chỉ cần 2 electron).
- Nếu có quá ít electron để thỏa mãn quy tắc octet, tạo các liên kết đôi hoặc liên kết ba.
Câu 8: Quy tắc octet là gì và tại sao nó lại quan trọng trong việc hình thành liên kết hóa học?
Quy tắc octet là quy tắc nói rằng các nguyên tử có xu hướng đạt được cấu hình electron với 8 electron trong lớp vỏ ngoài cùng (lớp hóa trị), tương tự như cấu hình của các khí hiếm. Quy tắc octet quan trọng vì các nguyên tử có cấu hình electron này rất bền vững. Việc đạt được cấu hình octet là động lực chính thúc đẩy các nguyên tử hình thành liên kết hóa học.
Câu 9: Có những ngoại lệ nào đối với quy tắc octet?
Có một số ngoại lệ đối với quy tắc octet, bao gồm:
- Các phân tử có số lẻ electron: Ví dụ, NO có 11 electron hóa trị.
- Các phân tử mà một nguyên tử có ít hơn 8 electron: Ví dụ, BF₃, BeCl₂.
- Các phân tử mà một nguyên tử có nhiều hơn 8 electron: Ví dụ, PCl₅, SF₆.
Câu 10: Làm thế nào để dự đoán hình dạng của một phân tử?
Hình dạng của một phân tử có thể được dự đoán bằng cách sử dụng lý thuyết VSEPR (Valence Shell Electron Pair Repulsion – Sự đẩy của các cặp electron lớp vỏ hóa trị). Lý thuyết VSEPR nói rằng các cặp electron xung quanh một nguyên tử trung tâm sẽ sắp xếp sao cho chúng ở xa nhau nhất có thể để giảm thiểu lực đẩy giữa chúng.
9. CAUHOI2025.EDU.VN – Nguồn Thông Tin Hóa Học Tin Cậy Cho Người Việt
Bạn đang tìm kiếm một nguồn thông tin hóa học đáng tin cậy và dễ hiểu? Hãy đến với CAUHOI2025.EDU.VN! Chúng tôi cung cấp các bài viết chi tiết, dễ hiểu về các chủ đề hóa học khác nhau, từ cơ bản đến nâng cao. Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng giải đáp mọi thắc mắc của bạn.
Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Thông tin chính xác, được kiểm chứng: Chúng tôi luôn đảm bảo rằng thông tin được cung cấp là chính xác và được lấy từ các nguồn uy tín.
- Giải thích dễ hiểu: Chúng tôi sử dụng ngôn ngữ đơn giản, dễ hiểu để giúp bạn nắm bắt kiến thức một cách nhanh chóng.
- Ví dụ minh họa: Chúng tôi cung cấp các ví dụ cụ thể để giúp bạn hiểu rõ hơn về các khái niệm hóa học.
- Bài tập vận dụng: Chúng tôi cung cấp các bài tập vận dụng để giúp bạn củng cố kiến thức.
10. Liên Hệ Với CAUHOI2025.EDU.VN
Nếu bạn có bất kỳ câu hỏi nào về liên kết ion, liên kết cộng hóa trị hoặc bất kỳ chủ đề hóa học nào khác, đừng ngần ngại liên hệ với chúng tôi!
- Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
- Số điện thoại: +84 2435162967
- Trang web: CAUHOI2025.EDU.VN
Hoặc bạn có thể truy cập trang “Liên hệ” trên website của chúng tôi để gửi câu hỏi trực tiếp. Đội ngũ chuyên gia của CAUHOI2025.EDU.VN luôn sẵn lòng hỗ trợ bạn!
11. Lời Kêu Gọi Hành Động (CTA)
Bạn đã nắm vững kiến thức về liên kết ion và liên kết cộng hóa trị rồi chứ? Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá thêm nhiều bài viết hữu ích khác về hóa học và các lĩnh vực khoa học khác! Đừng quên đặt câu hỏi cho chúng tôi nếu bạn có bất kỳ thắc mắc nào. CauHoi2025.EDU.VN luôn sẵn sàng đồng hành cùng bạn trên con đường chinh phục tri thức!
Hãy chia sẻ bài viết này đến bạn bè và những người quan tâm để cùng nhau học tập và phát triển!