**Bazơ Tan Và Không Tan Có Tính Chất Hóa Học Chung Là Gì?**
Bạn đang tìm hiểu về tính chất hóa học của bazơ tan và không tan? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp cho bạn câu trả lời chi tiết, dễ hiểu nhất về điểm chung quan trọng này, giúp bạn nắm vững kiến thức hóa học một cách hiệu quả. Cùng khám phá nhé!
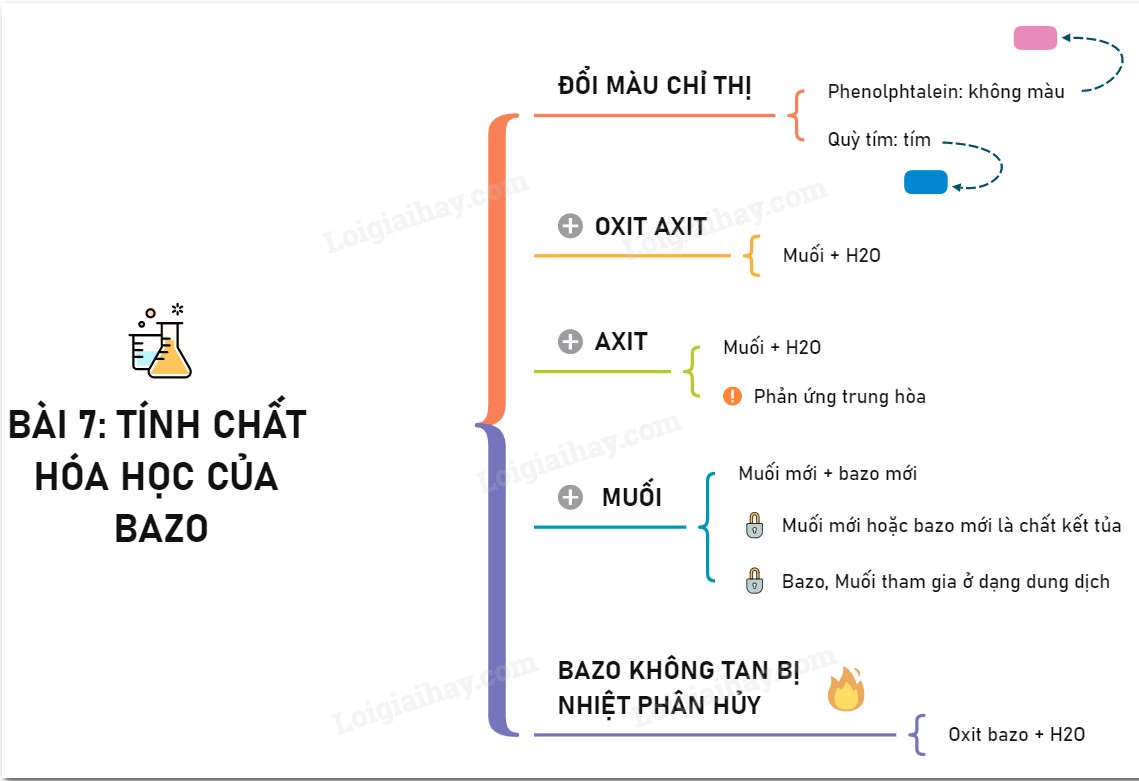
1. Tính Chất Hóa Học Chung Của Bazơ Tan Và Không Tan Là Gì?
Tính chất hóa học chung của bazơ tan và không tan là tác dụng với axit tạo thành muối và nước. Đây là phản ứng trung hòa, một trong những phản ứng quan trọng nhất trong hóa học vô cơ.
Ví dụ:
-
Bazơ tan (kiềm) tác dụng với axit:
NaOH (dung dịch) + HCl (dung dịch) → NaCl (dung dịch) + H2O (lỏng)
-
Bazơ không tan tác dụng với axit:
Cu(OH)2 (rắn) + 2HCl (dung dịch) → CuCl2 (dung dịch) + 2H2O (lỏng)
Phản ứng này xảy ra do ion hydroxide (OH-) trong bazơ kết hợp với ion hydrogen (H+) trong axit để tạo thành nước (H2O).
2. Phân Loại Bazơ: Tan và Không Tan
Để hiểu rõ hơn về tính chất hóa học của bazơ, chúng ta cần phân loại chúng dựa trên khả năng tan trong nước:
2.1. Bazơ Tan (Kiềm)
- Định nghĩa: Bazơ tan là những bazơ có khả năng hòa tan trong nước tạo thành dung dịch bazơ, còn gọi là dung dịch kiềm.
- Ví dụ: Các bazơ tan điển hình bao gồm:
- Natri hydroxit (NaOH)
- Kali hydroxit (KOH)
- Bari hydroxit (Ba(OH)2)
- Canxi hydroxit (Ca(OH)2) – ít tan
- Liti hydroxit (LiOH)
- Rubidi hydroxit (RbOH)
- Xesi hydroxit (CsOH)
- Stronti hydroxit (Sr(OH)2).
- Lưu ý: Ca(OH)2 tan ít trong nước, tạo thành nước vôi trong.
2.2. Bazơ Không Tan
- Định nghĩa: Bazơ không tan là những bazơ không hòa tan hoặc hòa tan rất ít trong nước.
- Ví dụ: Các bazơ không tan phổ biến bao gồm:
- Đồng(II) hydroxit (Cu(OH)2)
- Magie hydroxit (Mg(OH)2)
- Sắt(III) hydroxit (Fe(OH)3)
- Nhôm hydroxit (Al(OH)3)
- Kẽm hydroxit (Zn(OH)2)
3. Tính Chất Hóa Học Đặc Trưng Của Bazơ
Ngoài tính chất chung là tác dụng với axit, bazơ còn có những tính chất hóa học đặc trưng khác, được chia theo bazơ tan và bazơ không tan.
3.1. Tính Chất Hóa Học Của Bazơ Tan (Kiềm)
3.1.1. Tác dụng với chất chỉ thị màu
- Quỳ tím: Dung dịch bazơ làm quỳ tím chuyển sang màu xanh.
- Phenolphthalein: Dung dịch bazơ làm phenolphthalein không màu chuyển sang màu đỏ hoặc hồng.
3.1.2. Tác dụng với oxit axit
Dung dịch bazơ tác dụng với oxit axit tạo thành muối và nước.
Ví dụ:
2NaOH (dung dịch) + SO2 (khí) → Na2SO3 (dung dịch) + H2O (lỏng)
3Ca(OH)2 (dung dịch) + P2O5 (rắn) → Ca3(PO4)2 (rắn) + 3H2O (lỏng)
3.1.3. Tác dụng với dung dịch muối
Dung dịch bazơ có thể tác dụng với một số dung dịch muối tạo thành muối mới và bazơ mới. Phản ứng xảy ra khi sản phẩm tạo thành có chất kết tủa hoặc chất khí.
Ví dụ:
2NaOH (dung dịch) + CuSO4 (dung dịch) → Na2SO4 (dung dịch) + Cu(OH)2 (rắn, kết tủa màu xanh)
3.1.4. Tác dụng với kim loại lưỡng tính
Một số bazơ mạnh như NaOH, KOH có thể tác dụng với kim loại lưỡng tính như Al, Zn…
Ví dụ:
2NaOH (dung dịch) + 2Al (rắn) + 2H2O (lỏng) → 2NaAlO2 (dung dịch) + 3H2 (khí)

3.2. Tính Chất Hóa Học Của Bazơ Không Tan
3.2.1. Tác dụng với axit
Bazơ không tan tác dụng với axit tạo thành muối và nước (phản ứng trung hòa).
Ví dụ:
Cu(OH)2 (rắn) + 2HCl (dung dịch) → CuCl2 (dung dịch) + 2H2O (lỏng)
3.2.2. Bị nhiệt phân hủy
Nhiều bazơ không tan bị nhiệt phân hủy ở nhiệt độ cao tạo thành oxit kim loại và nước.
Ví dụ:
Cu(OH)2 (rắn) → CuO (rắn) + H2O (hơi) (khi đun nóng)
2Fe(OH)3 (rắn) → Fe2O3 (rắn) + 3H2O (hơi) (khi đun nóng)
4. Ứng Dụng Của Bazơ Trong Đời Sống Và Công Nghiệp
Bazơ có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất xà phòng: NaOH và KOH được sử dụng trong sản xuất xà phòng.
- Sản xuất giấy: NaOH được sử dụng trong quá trình sản xuất giấy từ bột gỗ.
- Xử lý nước: Ca(OH)2 (vôi tôi) được sử dụng để làm mềm nước cứng và khử chua đất.
- Sản xuất thuốc: Mg(OH)2 và Al(OH)3 được sử dụng trong một số loại thuốc kháng axit.
- Trong xây dựng: Ca(OH)2 là thành phần chính của vữa xây dựng.
- Sản xuất hóa chất: Bazơ là nguyên liệu quan trọng để sản xuất nhiều loại hóa chất khác.
5. So Sánh Tính Chất Hóa Học Của Bazơ Tan Và Không Tan
Để dễ dàng so sánh và nắm vững kiến thức, chúng ta có thể tổng hợp tính chất hóa học của bazơ tan và không tan trong bảng sau:
| Tính chất | Bazơ tan (kiềm) | Bazơ không tan |
|---|---|---|
| Tác dụng với axit | Có, tạo thành muối và nước | Có, tạo thành muối và nước |
| Tác dụng với oxit axit | Có, tạo thành muối và nước | Không |
| Tác dụng với muối | Có, tạo thành muối mới và bazơ mới (nếu sản phẩm có kết tủa hoặc khí) | Không |
| Tác dụng với chất chỉ thị màu | Đổi màu quỳ tím thành xanh, phenolphthalein không màu thành đỏ/hồng | Không |
| Bị nhiệt phân hủy | Không | Có, tạo thành oxit kim loại và nước |
| Khả năng hòa tan | Tan tốt trong nước | Không tan hoặc tan rất ít trong nước |
| Tác dụng với kim loại lưỡng tính | Có (với bazơ mạnh như NaOH, KOH) | Không |
6. Các Yếu Tố Ảnh Hưởng Đến Tính Bazơ
Cường độ tính bazơ của một chất phụ thuộc vào khả năng nhận proton (H+). Các yếu tố ảnh hưởng đến tính bazơ bao gồm:
- Độ âm điện: Các nguyên tố có độ âm điện thấp hơn có xu hướng cho điện tử dễ dàng hơn, làm tăng tính bazơ. Ví dụ, các kim loại kiềm (như Na, K) có tính bazơ mạnh hơn các kim loại kiềm thổ (như Mg, Ca).
- Kích thước ion: Ion có kích thước lớn hơn có mật độ điện tích nhỏ hơn, làm giảm khả năng hút proton và giảm tính bazơ.
- Hiệu ứng cảm ứng: Các nhóm thế hút điện tử làm giảm mật độ điện tích âm trên nguyên tử oxy của nhóm hydroxide (OH-), làm giảm tính bazơ. Ngược lại, các nhóm thế đẩy điện tử làm tăng tính bazơ.
- Sự cộng hưởng: Sự cộng hưởng có thể làm phân tán điện tích âm trên ion bazơ, làm giảm tính bazơ.
Theo PGS.TS Trần Thị Đà (Đại học Sư phạm Hà Nội), “Các yếu tố ảnh hưởng đến tính bazơ rất phức tạp và phụ thuộc vào cấu trúc phân tử của từng chất. Việc hiểu rõ các yếu tố này giúp chúng ta dự đoán và giải thích được tính chất của các bazơ khác nhau.”
7. Bài Tập Vận Dụng Về Bazơ Tan Và Không Tan
Để củng cố kiến thức, bạn có thể thử sức với một số bài tập vận dụng sau:
- Bài 1: Cho các chất sau: NaOH, Cu(OH)2, KOH, Fe(OH)3. Chất nào là bazơ tan, chất nào là bazơ không tan? Viết phương trình hóa học của các phản ứng xảy ra khi cho từng chất tác dụng với dung dịch HCl.
- Bài 2: Cho 100ml dung dịch NaOH 1M tác dụng với 50ml dung dịch CuSO4 1M. Tính khối lượng kết tủa tạo thành.
- Bài 3: Nhiệt phân hoàn toàn 19,6 gam Cu(OH)2. Tính khối lượng CuO thu được sau phản ứng.
- Bài 4: Cho 5,4 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Tính thể tích khí H2 thu được (đktc).
- Bài 5: Trình bày phương pháp hóa học để phân biệt hai dung dịch NaOH và MgCl2. Viết phương trình hóa học của các phản ứng xảy ra.
8. Câu Hỏi Thường Gặp (FAQ) Về Bazơ
-
Bazơ là gì?
Bazơ là hợp chất hóa học khi tan trong nước tạo ra ion hydroxide (OH-).
-
Làm thế nào để nhận biết một dung dịch là bazơ?
Dung dịch bazơ làm quỳ tím chuyển sang màu xanh và phenolphthalein không màu chuyển sang màu đỏ hoặc hồng.
-
Bazơ có ăn mòn không?
Một số bazơ mạnh như NaOH, KOH có tính ăn mòn cao, có thể gây bỏng da và tổn thương mắt.
-
Tại sao bazơ tan còn gọi là kiềm?
Vì bazơ tan có vị đắng và tính chất xà phòng, tương tự như các chất kiềm.
-
Bazơ có tác dụng với kim loại không?
Chỉ một số bazơ mạnh như NaOH, KOH mới tác dụng với kim loại lưỡng tính như Al, Zn.
-
Sản phẩm của phản ứng giữa bazơ và axit là gì?
Sản phẩm của phản ứng giữa bazơ và axit là muối và nước.
-
Ứng dụng của Ca(OH)2 là gì?
Ca(OH)2 (vôi tôi) được sử dụng để làm mềm nước cứng, khử chua đất, sản xuất vữa xây dựng.
-
Tại sao cần phân loại bazơ thành tan và không tan?
Vì bazơ tan và không tan có tính chất hóa học khác nhau, việc phân loại giúp chúng ta dự đoán và điều khiển các phản ứng hóa học liên quan đến bazơ.
-
Bazơ nào được sử dụng trong sản xuất xà phòng?
NaOH (xút ăn da) và KOH (kali hydroxit) được sử dụng trong sản xuất xà phòng.
-
Điều gì xảy ra khi nhiệt phân một bazơ không tan?
Bazơ không tan bị nhiệt phân hủy tạo thành oxit kim loại và nước.
9. Kết Luận
Mặc dù có sự khác biệt về khả năng tan trong nước, bazơ tan và không tan đều có tính chất hóa học chung quan trọng là tác dụng với axit tạo thành muối và nước. Hiểu rõ tính chất này, cùng với các tính chất đặc trưng khác của từng loại bazơ, sẽ giúp bạn nắm vững kiến thức hóa học và ứng dụng chúng vào thực tế một cách hiệu quả.
Nếu bạn vẫn còn thắc mắc hoặc muốn tìm hiểu sâu hơn về các chủ đề hóa học khác, hãy truy cập CAUHOI2025.EDU.VN để khám phá thêm nhiều thông tin hữu ích và đặt câu hỏi cho các chuyên gia của chúng tôi. Chúng tôi luôn sẵn sàng hỗ trợ bạn trên con đường chinh phục kiến thức!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967.
Trang web: CAUHOI2025.EDU.VN
Đừng quên theo dõi CAUHOI2025.EDU.VN để cập nhật những bài viết mới nhất và tham gia cộng đồng học tập sôi động của chúng tôi nhé!
Từ khóa liên quan: Tính chất bazơ, bazơ tan, bazơ không tan, phản ứng trung hòa, hóa học vô cơ.
10. Lời Kêu Gọi Hành Động (CTA)
Bạn có đang gặp khó khăn trong việc học hóa học? Bạn muốn tìm kiếm một nguồn thông tin đáng tin cậy và dễ hiểu? Hãy truy cập ngay CAUHOI2025.EDU.VN để khám phá kho tàng kiến thức phong phú và đặt câu hỏi cho các chuyên gia của chúng tôi. Chúng tôi cam kết mang đến cho bạn những giải đáp chính xác, nhanh chóng và hữu ích nhất. Đừng bỏ lỡ cơ hội nâng cao kiến thức và chinh phục môn hóa học cùng CauHoi2025.EDU.VN!


