Chất Nào Làm Mất Màu KMnO4? Giải Thích Chi Tiết Nhất
Bạn đang thắc mắc Chất Nào Làm Mất Màu Kmno4? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp thông tin chi tiết về các chất vô cơ và hữu cơ có khả năng làm mất màu dung dịch thuốc tím (KMnO4), cùng với giải thích cặn kẽ về cơ chế phản ứng. Tìm hiểu ngay để nắm vững kiến thức hóa học quan trọng này!
1. Giới Thiệu Chung Về KMnO4 Và Khả Năng Oxi Hóa
KMnO4, hay kali pemanganat, là một chất oxi hóa mạnh được sử dụng rộng rãi trong hóa học. Dung dịch KMnO4 có màu tím đặc trưng, và khả năng làm mất màu dung dịch này là một dấu hiệu quan trọng để nhận biết sự có mặt của các chất khử. Vậy, những chất nào có thể phản ứng với KMnO4 và làm mất màu tím của nó? CAUHOI2025.EDU.VN sẽ giúp bạn khám phá điều này.
2. Các Hợp Chất Hữu Cơ Làm Mất Màu KMnO4
2.1. Hydrocarbon Không No (Alkene, Alkadiene, Alkyne)
Alkene, alkadiene và alkyne là những hydrocarbon chứa liên kết đôi (C=C) hoặc liên kết ba (C≡C). Các liên kết này dễ bị oxi hóa bởi KMnO4, làm mất màu dung dịch. Đây là phản ứng oxi hóa không hoàn toàn, thường được sử dụng để điều chế các dẫn xuất chứa oxy của hydrocarbon trong công nghiệp.
-
Alkene: (Công thức tổng quát CnH2n, n ≥ 2)
Ví dụ:
3CH2=CH2 + 2KMnO4 + 4H2O → 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
(Ethylene)
-
Alkyne: (Công thức tổng quát CnH2n-2, n ≥ 2)
Ví dụ:
3C2H2 + 8KMnO4 → 3(COOK)2 + 8MnO2↓ + 2KOH + 2H2O
(MnO2 là chất kết tủa màu nâu đen)
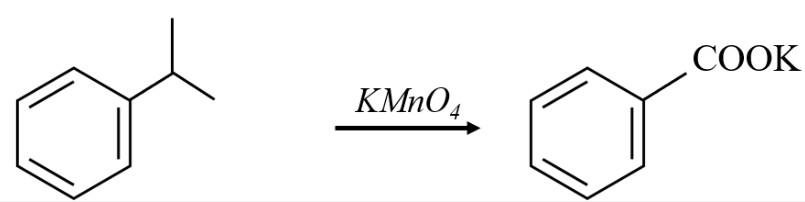
2.2. Hydrocarbon Thơm (Arene)
Không phải tất cả arene đều phản ứng với KMnO4. Benzene và toluene không phản ứng ở điều kiện thường. Tuy nhiên, alkylbenzene có thể bị oxi hóa bởi KMnO4 khi đun nóng.
-
Toluen: Làm mất màu KMnO4 ở nhiệt độ 80-100°C
C6H5-CH3 + 2KMnO4 → C6H5-COOK + 2MnO2↓ + KOH + H2O
(Toluen)
-
Styrene: Làm mất màu KMnO4 ngay ở nhiệt độ thường do nhóm vinyl (CH=CH2) bị oxi hóa tương tự ethylene.
3C6H5-CH=CH2 + 10KMnO4 → 3C6H5COOK + 3K2CO3 + 10MnO2 + KOH + 4H2O
(Styrene)
-
Cumene: Cũng làm mất màu dung dịch KMnO4.

2.3. Hợp Chất Carbonyl
Formaldehyde (HCHO) có khả năng làm mất màu dung dịch thuốc tím:
HCHO + KMnO4 → HCOOK + H2O + MnO2
2.4. Các hợp chất khác
Các hợp chất hữu cơ khác như alcohol, aldehyde, acid formic (HCOOH) cũng có khả năng làm mất màu dung dịch KMnO4.
3. Các Hợp Chất Vô Cơ Làm Mất Màu KMnO4
Dung dịch làm mất màu KMnO4 thường chứa các chất khử mạnh, có khả năng khử Mn7+ trong KMnO4 về Mn2+. Một số chất phổ biến bao gồm:
- H2SO3: Axit sunfurơ là chất khử mạnh, tạo SO2 làm mất màu KMnO4.
- H2S: Khí hydro sulfide (khí sunfua) là chất khử mạnh, tạo S2- làm mất màu KMnO4.
- (NH4)2SO3: Có tính khử tương tự H2SO3.
- Fe2+ hoặc Sn2+: Ion sắt(II) hoặc ion thiếc(II) là các chất khử mạnh, tạo ion sắt(III) hoặc ion thiếc(IV) làm mất màu KMnO4.
- Muối sunfua và halogenua: Các muối sunfua tan và halogenua (trừ F-) cũng có thể bị oxi hóa bởi KMnO4.
4. Tính Chất Hóa Học Của KMnO4
KMnO4 có tính oxi hóa mạnh do Mn có số oxi hóa +7 cực đại. Tính oxi hóa của KMnO4 phụ thuộc vào môi trường phản ứng:
-
Môi trường axit: KMnO4 bị khử thành Mn2+. Nó có khả năng oxi hóa các halogenua (trừ F-), các muối sulfua tan, H2S, H nguyên tử, các chất hữu cơ và các chất khử khác.
Ví dụ:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
4KMnO4 + 5C2H5OH + 6H2SO4 → 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
2KMnO4 + 10KI + 8H2SO4 → 6K2SO4 + 2MnSO4 + 5I2 + 8H2O
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 10CO2 + K2SO4 + 2MnSO4 + 8H2O
-
Môi trường trung tính: KMnO4 bị khử thành MnO2. KMnO4 có thể oxi hóa H2S, ethanol…
Ví dụ:
2KMnO4 + 3H2S → 2MnO2 + 3S + 2KOH + 2H2O
2KMnO4 + 3CH3CH2OH → 2MnO2 + 3CH3CHO + 2KOH + 2H2O
-
Môi trường bazơ: KMnO4 bị khử thành MnO42-.
Ví dụ:
2KMnO4 + K2SO3 + 2KOH → 2K2MnO4 + K2SO4 + H2O
2KMnO4 + KCN + 2KOH → 2K2MnO4 + KOCN + H2O
-
Điều kiện nhiệt độ cao: KMnO4 tự phân hủy sinh ra oxy, ngoài ra nó oxi hóa mạnh nhiều phi kim và các chất khử khác.
Ví dụ:
2KMnO4 → K2MnO4 + MnO2 + O2
2KMnO4 + C → K2MnO4 + MnO2 + CO2
2KMnO4 + S → K2MnO4 + MnO2 + SO2
10KMnO4 + 4P → 5K2MnO4 + 5MnO2 + 2P2O5
5. Ứng Dụng Của Phản Ứng Làm Mất Màu KMnO4
Phản ứng làm mất màu KMnO4 có nhiều ứng dụng quan trọng:
- Nhận biết các chất khử: Dùng để xác định sự có mặt của các chất khử trong dung dịch.
- Điều chế hóa chất: Sử dụng trong các phản ứng oxi hóa để điều chế các hợp chất hữu cơ và vô cơ.
- Khử trùng và làm sạch: KMnO4 có tính sát khuẩn, được sử dụng để khử trùng nước và làm sạch vết thương.
- Phân tích hóa học: Sử dụng trong chuẩn độ oxi hóa – khử để xác định nồng độ các chất.
6. Bảng Tổng Hợp Các Chất Làm Mất Màu KMnO4
Để dễ dàng theo dõi, CAUHOI2025.EDU.VN cung cấp bảng tổng hợp các chất làm mất màu KMnO4:
| Loại chất | Ví dụ | Điều kiện phản ứng | Sản phẩm chính |
|---|---|---|---|
| Alkene | Ethylene (C2H4) | Thường | Ethylene glycol (HO-CH2-CH2-OH) |
| Alkyne | Acetylene (C2H2) | Thường | Muối của axit oxalic (COOK)2 |
| Alkylbenzene | Toluen (C6H5-CH3) | Đun nóng (80-100°C) | Muối của axit benzoic (C6H5-COOK) |
| Styrene | C6H5-CH=CH2 | Thường | C6H5COOK, K2CO3 |
| Formaldehyde | HCHO | Thường | HCOOK, MnO2 |
| Axit sunfurơ | H2SO3 | Thường | H2SO4 |
| Hydro sulfide | H2S | Thường | S |
| Ion sắt(II) | Fe2+ | Thường | Fe3+ |
| Ion thiếc(II) | Sn2+ | Thường | Sn4+ |
7. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Làm Mất Màu KMnO4
Một số yếu tố có thể ảnh hưởng đến tốc độ và hiệu quả của phản ứng làm mất màu KMnO4:
- Nhiệt độ: Nhiệt độ cao thường làm tăng tốc độ phản ứng.
- pH của dung dịch: Môi trường axit, trung tính hay bazơ sẽ ảnh hưởng đến sản phẩm phản ứng và khả năng oxi hóa của KMnO4.
- Nồng độ các chất phản ứng: Nồng độ KMnO4 và chất khử càng cao, phản ứng diễn ra càng nhanh.
- Chất xúc tác: Một số chất xúc tác có thể làm tăng tốc độ phản ứng.
8. Lưu Ý Khi Sử Dụng KMnO4
Khi làm việc với KMnO4, cần lưu ý:
- Tính ăn mòn: KMnO4 có tính ăn mòn, cần tránh tiếp xúc trực tiếp với da và mắt.
- Tính oxi hóa mạnh: KMnO4 là chất oxi hóa mạnh, có thể gây cháy nổ khi tiếp xúc với các chất dễ cháy.
- Bảo quản: Bảo quản KMnO4 ở nơi khô ráo, thoáng mát, tránh ánh sáng trực tiếp.
9. Tại Sao Nên Tìm Hiểu Về Các Chất Làm Mất Màu KMnO4 Tại CAUHOI2025.EDU.VN?
CAUHOI2025.EDU.VN cung cấp thông tin chính xác, dễ hiểu và được trình bày một cách khoa học. Chúng tôi luôn cập nhật những kiến thức mới nhất và đảm bảo tính tin cậy của thông tin. Ngoài ra, CAUHOI2025.EDU.VN còn có đội ngũ chuyên gia sẵn sàng giải đáp mọi thắc mắc của bạn.
10. Câu Hỏi Thường Gặp (FAQ)
-
Chất nào làm mất màu KMnO4 nhanh nhất?
- Các chất khử mạnh như H2S, H2SO3, Fe2+ thường làm mất màu KMnO4 nhanh hơn so với các hydrocarbon không no.
-
Tại sao alkene làm mất màu KMnO4?
- Do liên kết đôi (C=C) trong alkene dễ bị oxi hóa bởi KMnO4.
-
KMnO4 có thể dùng để khử trùng không?
- Có, KMnO4 có tính sát khuẩn và được sử dụng để khử trùng nước và làm sạch vết thương.
-
Phản ứng giữa KMnO4 và toluene cần điều kiện gì?
- Cần đun nóng ở nhiệt độ 80-100°C.
-
MnO2 sinh ra trong phản ứng có màu gì?
- Màu nâu đen.
-
KMnO4 có độc không?
- KMnO4 có tính ăn mòn và có thể gây kích ứng da và mắt.
-
Làm thế nào để bảo quản KMnO4?
- Bảo quản ở nơi khô ráo, thoáng mát, tránh ánh sáng trực tiếp.
-
KMnO4 có phản ứng với hydrocarbon no không?
- Không, hydrocarbon no (alkane, cycloalkane) không phản ứng với KMnO4.
-
Môi trường nào KMnO4 có tính oxi hóa mạnh nhất?
- Môi trường axit.
-
Ứng dụng của phản ứng làm mất màu KMnO4 là gì?
- Nhận biết các chất khử, điều chế hóa chất, khử trùng, và phân tích hóa học.
Kết Luận
Hiểu rõ các chất làm mất màu KMnO4 và cơ chế phản ứng là rất quan trọng trong hóa học. Hy vọng bài viết này của CAUHOI2025.EDU.VN đã cung cấp cho bạn những thông tin hữu ích. Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại liên hệ với chúng tôi.
Bạn vẫn còn thắc mắc về các phản ứng hóa học khác? Hãy truy cập ngay CAUHOI2025.EDU.VN để khám phá thêm nhiều kiến thức thú vị và bổ ích! Đừng quên chia sẻ bài viết này đến bạn bè và người thân để cùng nhau học tập và phát triển.
Liên hệ với CAUHOI2025.EDU.VN:
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN


