Delta H 0 Là Phản Ứng Thu Nhiệt? Giải Thích Chi Tiết Nhất
Đoạn giới thiệu: Bạn đang thắc mắc về delta H 0 và mối liên hệ của nó với phản ứng thu nhiệt? CAUHOI2025.EDU.VN sẽ giải thích chi tiết về delta H 0 (biến thiên enthalpy chuẩn), phản ứng thu nhiệt là gì, cách xác định chúng, cùng các ví dụ minh họa dễ hiểu. Khám phá ngay để nắm vững kiến thức hóa học quan trọng này và áp dụng vào thực tế, đồng thời hiểu rõ hơn về nhiệt động học và các loại phản ứng hóa học.
1. Phản Ứng Thu Nhiệt: Khái Niệm Cơ Bản
Phản ứng thu nhiệt là quá trình hóa học mà trong đó hệ thống hấp thụ năng lượng từ môi trường xung quanh dưới dạng nhiệt. Điều này có nghĩa là, để phản ứng xảy ra, cần phải cung cấp nhiệt từ bên ngoài.
Khi phản ứng thu nhiệt diễn ra, nhiệt độ của môi trường xung quanh sẽ giảm xuống do nhiệt lượng bị hấp thụ vào phản ứng. Đây là một dấu hiệu quan trọng để nhận biết phản ứng thu nhiệt.
Ví dụ điển hình về phản ứng thu nhiệt là quá trình hòa tan muối amoni clorua (NH4Cl) vào nước. Khi muối tan, cốc đựng dung dịch sẽ trở nên lạnh hơn do quá trình hòa tan đã hấp thụ nhiệt từ môi trường xung quanh.
Theo một nghiên cứu của Đại học Quốc gia Hà Nội, Khoa Hóa học, năm 2023, các phản ứng thu nhiệt thường có vai trò quan trọng trong các quá trình công nghiệp làm lạnh và bảo quản thực phẩm.
2. Delta H 0 Là Gì? Mối Liên Hệ Với Phản Ứng Thu Nhiệt
Delta H 0 (ΔH°) là ký hiệu biểu thị biến thiên enthalpy chuẩn của một phản ứng hóa học. Enthalpy (H) là một hàm trạng thái nhiệt động học, mô tả tổng năng lượng bên trong của hệ thống và tích của áp suất và thể tích. Biến thiên enthalpy (ΔH) cho biết lượng nhiệt được hấp thụ hoặc giải phóng trong một phản ứng hóa học ở áp suất không đổi.
- Delta H 0 > 0: Phản ứng thu nhiệt. Giá trị dương của delta H 0 chỉ ra rằng hệ thống hấp thụ nhiệt từ môi trường. Năng lượng cần thiết để phá vỡ các liên kết trong chất phản ứng lớn hơn năng lượng giải phóng khi hình thành các liên kết mới trong sản phẩm.
- Delta H 0 < 0: Phản ứng tỏa nhiệt. Giá trị âm của delta H 0 chỉ ra rằng hệ thống giải phóng nhiệt ra môi trường. Năng lượng giải phóng khi hình thành các liên kết mới trong sản phẩm lớn hơn năng lượng cần thiết để phá vỡ các liên kết trong chất phản ứng.
- Delta H 0 = 0: Phản ứng trung hòa. Trong trường hợp này, không có sự hấp thụ hoặc giải phóng nhiệt đáng kể.

2.1. Ý Nghĩa Của Dấu Và Giá Trị Delta H 0
- Dấu (+): Phản ứng thu nhiệt, cần cung cấp năng lượng.
- Dấu (-): Phản ứng tỏa nhiệt, giải phóng năng lượng.
- Giá trị: Lượng nhiệt (kJ hoặc kcal) trao đổi trong phản ứng khi các chất phản ứng chuyển thành sản phẩm theo đúng hệ số tỷ lượng trong phương trình hóa học.
Ví dụ, xét phản ứng nhiệt phân canxi cacbonat (CaCO3):
CaCO3(s) → CaO(s) + CO2(g) ΔH° = +178 kJ/mol
Delta H 0 dương (+178 kJ/mol) cho biết đây là phản ứng thu nhiệt. Để phân hủy 1 mol CaCO3 thành CaO và CO2, cần cung cấp 178 kJ nhiệt lượng.
2.2. Điều Kiện Chuẩn
Giá trị delta H 0 thường được đo ở điều kiện chuẩn, tức là 25°C (298 K) và áp suất 1 bar. Điều kiện chuẩn giúp so sánh và đối chiếu các giá trị delta H 0 của các phản ứng khác nhau một cách chính xác.
3. Cách Xác Định Phản Ứng Thu Nhiệt
Có nhiều cách để xác định một phản ứng là thu nhiệt:
- Đo sự thay đổi nhiệt độ: Nếu nhiệt độ của môi trường xung quanh giảm xuống trong quá trình phản ứng, đó là phản ứng thu nhiệt.
- Kiểm tra dấu của delta H 0: Nếu delta H 0 có giá trị dương, đó là phản ứng thu nhiệt.
- Quan sát quá trình: Một số phản ứng thu nhiệt cần cung cấp năng lượng liên tục để duy trì, ví dụ như phản ứng quang hợp.
- Sử dụng phương trình nhiệt hóa học: Phương trình này ghi rõ giá trị delta H 0, giúp xác định loại phản ứng.
3.1. Sử Dụng Phương Trình Nhiệt Hóa Học
Phương trình nhiệt hóa học là phương trình hóa học cân bằng, kèm theo giá trị delta H 0. Ví dụ:
N2(g) + O2(g) → 2NO(g) ΔH° = +180 kJ
Phương trình này cho thấy phản ứng tạo thành NO từ N2 và O2 là thu nhiệt, với delta H 0 = +180 kJ.
3.2. Thực Nghiệm Thực Tế
Trong phòng thí nghiệm, bạn có thể sử dụng nhiệt kế để đo sự thay đổi nhiệt độ trong quá trình phản ứng. Nếu nhiệt độ giảm, phản ứng là thu nhiệt.
4. Ví Dụ Về Phản Ứng Thu Nhiệt
-
Phản ứng quang hợp: Cây xanh sử dụng năng lượng ánh sáng mặt trời để chuyển đổi CO2 và H2O thành glucose và O2.
6CO2(g) + 6H2O(l) → C6H12O6(s) + 6O2(g) ΔH° = +2803 kJ
-
Phản ứng nhiệt phân: Phân hủy các hợp chất bằng nhiệt, ví dụ như nhiệt phân CaCO3.
-
Phản ứng điện phân: Sử dụng điện năng để thực hiện các phản ứng hóa học, ví dụ như điện phân nước.
2H2O(l) → 2H2(g) + O2(g) ΔH° = +286 kJ
-
Hòa tan một số muối: Như đã đề cập, hòa tan NH4Cl trong nước là một quá trình thu nhiệt.
5. Ứng Dụng Của Phản Ứng Thu Nhiệt
Phản ứng thu nhiệt có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất phân bón: Một số quá trình sản xuất phân bón cần sử dụng phản ứng thu nhiệt để tổng hợp các hợp chất.
- Công nghệ làm lạnh: Sử dụng các phản ứng thu nhiệt để tạo ra hiệu ứng làm lạnh trong tủ lạnh, điều hòa không khí. Theo Báo Công Thương năm 2022, công nghệ làm lạnh dựa trên phản ứng thu nhiệt đang được nghiên cứu và phát triển để thay thế các chất làm lạnh gây hại cho môi trường.
- Điều chế hóa chất: Nhiều hóa chất quan trọng được điều chế thông qua các phản ứng thu nhiệt.
- Nghiên cứu khoa học: Phản ứng thu nhiệt được sử dụng trong các thí nghiệm để nghiên cứu tính chất của vật chất và các quá trình hóa học.
6. Phân Biệt Phản Ứng Thu Nhiệt Và Phản Ứng Tỏa Nhiệt
| Đặc điểm | Phản ứng thu nhiệt | Phản ứng tỏa nhiệt |
|---|---|---|
| Delta H 0 | > 0 (dương) | < 0 (âm) |
| Năng lượng | Hấp thụ nhiệt từ môi trường | Giải phóng nhiệt ra môi trường |
| Nhiệt độ | Nhiệt độ môi trường giảm | Nhiệt độ môi trường tăng |
| Tính tự xảy ra | Thường không tự xảy ra, cần cung cấp năng lượng | Có thể tự xảy ra |
| Ví dụ | Quang hợp, nhiệt phân CaCO3, hòa tan NH4Cl | Đốt cháy nhiên liệu, phản ứng trung hòa axit-bazơ, hình thành nước từ H2 và O2 |
| Ứng dụng | Làm lạnh, sản xuất phân bón, điều chế hóa chất | Phát điện, sưởi ấm, sản xuất năng lượng |
7. Các Yếu Tố Ảnh Hưởng Đến Delta H 0
- Nhiệt độ: Delta H 0 có thể thay đổi theo nhiệt độ.
- Áp suất: Áp suất ảnh hưởng đến delta H 0 của các phản ứng có sự thay đổi về số mol khí.
- Trạng thái vật chất: Delta H 0 phụ thuộc vào trạng thái vật chất (rắn, lỏng, khí) của các chất phản ứng và sản phẩm.
- Nồng độ: Nồng độ ảnh hưởng đến delta H 0 của các phản ứng trong dung dịch.
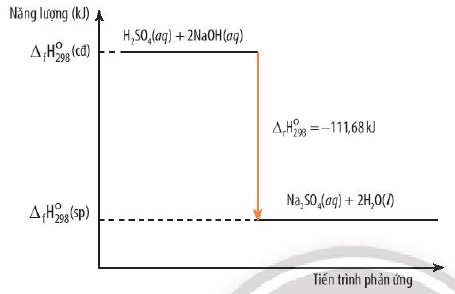
8. Biến Thiên Enthalpy Chuẩn Của Phản Ứng (ΔrHo298)
8.1. Định Nghĩa
Biến thiên enthalpy chuẩn của phản ứng (ΔrHo298) là lượng nhiệt tỏa ra hoặc thu vào khi một phản ứng hóa học xảy ra hoàn toàn trong điều kiện chuẩn (298 K và 1 bar).
8.2. Cách Tính
ΔrHo298 có thể được tính bằng nhiều cách:
-
Sử dụng enthalpy tạo thành chuẩn (ΔfHo298):
ΔrHo298 = Σ ΔfHo298(sản phẩm) – Σ ΔfHo298(chất phản ứng)
-
Sử dụng định luật Hess: Nếu một phản ứng có thể được biểu diễn bằng một chuỗi các phản ứng khác, ΔrHo298 của phản ứng tổng bằng tổng ΔrHo298 của các phản ứng thành phần.
-
Sử dụng năng lượng liên kết:
ΔrHo298 ≈ Σ năng lượng liên kết (chất phản ứng) – Σ năng lượng liên kết (sản phẩm)
8.3. Lưu Ý Quan Trọng
- Enthalpy tạo thành chuẩn của một đơn chất ở trạng thái bền vững nhất ở điều kiện chuẩn bằng 0.
- Giá trị ΔrHo298 thường được cung cấp trong các bảng số liệu nhiệt động.
9. Phương Trình Nhiệt Hóa Học
9.1. Khái Niệm
Phương trình nhiệt hóa học là phương trình hóa học cân bằng, trong đó chỉ rõ trạng thái vật chất của các chất và giá trị biến thiên enthalpy chuẩn của phản ứng (ΔrHo298).
9.2. Ví Dụ
H2(g) + 1/2O2(g) → H2O(l) ΔrHo298 = -286 kJ
Phương trình này cho biết:
- Phản ứng tạo thành 1 mol H2O lỏng từ H2 và O2 là phản ứng tỏa nhiệt.
- Khi phản ứng xảy ra hoàn toàn ở điều kiện chuẩn, 286 kJ nhiệt lượng được giải phóng.
10. Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng Thu Nhiệt và Delta H 0
-
Phản ứng thu nhiệt là gì?
Phản ứng thu nhiệt là phản ứng hóa học hấp thụ nhiệt từ môi trường, làm giảm nhiệt độ của môi trường xung quanh.
-
Delta H 0 là gì và nó liên quan đến phản ứng thu nhiệt như thế nào?
Delta H 0 là biến thiên enthalpy chuẩn của một phản ứng. Nếu delta H 0 > 0, phản ứng là thu nhiệt.
-
Làm thế nào để xác định một phản ứng là thu nhiệt?
Bạn có thể đo sự thay đổi nhiệt độ, kiểm tra dấu của delta H 0, quan sát quá trình phản ứng hoặc sử dụng phương trình nhiệt hóa học.
-
Cho ví dụ về một phản ứng thu nhiệt?
Phản ứng quang hợp, nhiệt phân CaCO3, hòa tan NH4Cl trong nước là những ví dụ điển hình.
-
Phản ứng thu nhiệt có ứng dụng gì trong đời sống và công nghiệp?
Phản ứng thu nhiệt được sử dụng trong sản xuất phân bón, công nghệ làm lạnh, điều chế hóa chất và nghiên cứu khoa học.
-
Delta H 0 có phụ thuộc vào nhiệt độ không?
Có, delta H 0 có thể thay đổi theo nhiệt độ.
-
Biến thiên enthalpy chuẩn của phản ứng là gì?
Biến thiên enthalpy chuẩn của phản ứng là lượng nhiệt tỏa ra hoặc thu vào khi một phản ứng hóa học xảy ra hoàn toàn trong điều kiện chuẩn (298 K và 1 bar).
-
Làm thế nào để tính biến thiên enthalpy chuẩn của phản ứng?
Bạn có thể sử dụng enthalpy tạo thành chuẩn, định luật Hess hoặc năng lượng liên kết.
-
Phương trình nhiệt hóa học là gì?
Phương trình nhiệt hóa học là phương trình hóa học cân bằng, trong đó chỉ rõ trạng thái vật chất của các chất và giá trị biến thiên enthalpy chuẩn của phản ứng.
-
Tại sao cần phải đo delta H 0 ở điều kiện chuẩn?
Để có thể so sánh và đối chiếu các giá trị delta H 0 của các phản ứng khác nhau một cách chính xác.
CAUHOI2025.EDU.VN hy vọng rằng bài viết này đã giúp bạn hiểu rõ hơn về delta H 0 và mối liên hệ của nó với phản ứng thu nhiệt. Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại liên hệ với chúng tôi.
Bạn đang gặp khó khăn trong việc nắm bắt các kiến thức hóa học phức tạp và cần một nguồn thông tin đáng tin cậy, dễ hiểu? Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay! Tại đây, bạn sẽ tìm thấy câu trả lời cho mọi thắc mắc, cùng với các bài viết, hướng dẫn chi tiết và dịch vụ tư vấn chuyên nghiệp. Đừng bỏ lỡ cơ hội nâng cao kiến thức và đạt kết quả tốt nhất trong học tập!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN
