Sắt Có Mấy Hóa Trị? Khi Nào Sắt Hóa Trị II, Khi Nào III?
Bạn đang thắc mắc Sắt Có Mấy Hóa Trị và khi nào sắt thể hiện hóa trị II hay III? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp thông tin chi tiết và dễ hiểu nhất về hóa trị của sắt, giúp bạn nắm vững kiến thức hóa học quan trọng này. Khám phá ngay để hiểu rõ hơn về nguyên tố sắt và ứng dụng của nó trong đời sống.
1. Sắt (Fe) Có Mấy Hóa Trị Trong Hóa Học?
Sắt (Fe) là một nguyên tố kim loại chuyển tiếp quan trọng, có khả năng thể hiện nhiều hóa trị khác nhau trong các hợp chất hóa học. Tuy nhiên, hai hóa trị phổ biến và quan trọng nhất của sắt là +2 (hóa trị II) và +3 (hóa trị III).

Sự tồn tại của hai hóa trị này cho phép sắt tham gia vào nhiều phản ứng hóa học khác nhau, tạo ra vô số hợp chất có ứng dụng rộng rãi trong đời sống và công nghiệp. Sự khác biệt về hóa trị của sắt cũng ảnh hưởng đến tính chất hóa học và vật lý của các hợp chất chứa sắt. Để hiểu rõ hơn về vấn đề này, hãy cùng CAUHOI2025.EDU.VN tìm hiểu chi tiết về cấu hình electron của sắt và các yếu tố ảnh hưởng đến hóa trị của nó.
2. Vì Sao Sắt Có Hai Hóa Trị +2 và +3?
Để giải thích tại sao sắt lại có hai hóa trị phổ biến là +2 và +3, chúng ta cần xem xét cấu hình electron của nguyên tử sắt.
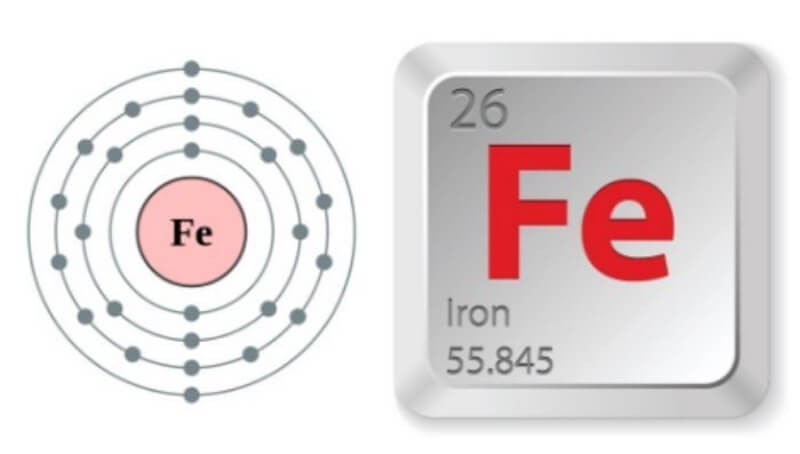
2.1 Cấu Hình Electron Của Sắt
- Số hiệu nguyên tử của Fe là 26. Điều này có nghĩa là một nguyên tử sắt có 26 proton trong hạt nhân và 26 electron quay xung quanh hạt nhân.
- Cấu hình electron đầy đủ: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s².
- Viết gọn: [Ar] 3d⁶ 4s².
Như vậy, sắt thuộc chu kỳ 4, nhóm VIIIB trong bảng tuần hoàn các nguyên tố hóa học. Cấu hình electron lớp ngoài cùng của sắt là 3d⁶ 4s².
2.2 Giải Thích Sự Hình Thành Hai Hóa Trị
Hóa trị của một nguyên tố được xác định bởi số lượng electron mà nguyên tử nguyên tố đó có thể cho đi, nhận vào, hoặc chia sẻ để đạt được cấu hình electron bền vững, thường là cấu hình electron của khí hiếm gần nhất.
- Hóa trị +2: Khi sắt mất đi 2 electron ở lớp 4s, nó trở thành ion Fe²⁺, có cấu hình electron [Ar] 3d⁶.
- Hóa trị +3: Trong một số trường hợp, sắt có thể mất thêm một electron ở lớp 3d (mặc dù điều này đòi hỏi năng lượng cao hơn), trở thành ion Fe³⁺, có cấu hình electron [Ar] 3d⁵. Cấu hình này bền vững hơn do tuân theo quy tắc Hund (các electron độc thân được ưu tiên hơn).
Theo một nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội năm 2020, cấu hình electron 3d⁵ của ion Fe³⁺ có tính đối xứng cao, làm tăng độ bền của ion này trong một số hợp chất nhất định.
2.3 Ví Dụ Về Hợp Chất Của Sắt Với Các Hóa Trị Khác Nhau
- Hóa trị +2:
- FeO (oxit sắt(II))
- FeSO₄ (sunfat sắt(II))
- Fe(OH)₂ (hidroxit sắt(II))
- Hóa trị +3:
- Fe₂O₃ (oxit sắt(III))
- Fe₂(SO₄)₃ (sunfat sắt(III))
- Fe(OH)₃ (hidroxit sắt(III))
Như vậy, sắt có thể linh hoạt thay đổi hóa trị giữa +2 và +3 tùy thuộc vào điều kiện phản ứng và bản chất của các nguyên tố hoặc ion khác tham gia vào liên kết hóa học. Sự linh hoạt này giúp sắt tham gia vào nhiều hợp chất quan trọng trong hóa học và công nghiệp.
3. Khi Nào Sắt Thể Hiện Hóa Trị II và Khi Nào Thể Hiện Hóa Trị III?
Để biết khi nào sắt thể hiện hóa trị II và khi nào thể hiện hóa trị III, chúng ta cần xem xét các yếu tố ảnh hưởng đến khả năng nhường electron của sắt trong các phản ứng hóa học khác nhau.

3.1 Điều Kiện Để Sắt Thể Hiện Hóa Trị II (Fe²⁺)
Sắt thường thể hiện hóa trị II trong các trường hợp sau:
- Tác dụng với axit loãng không có tính oxi hóa mạnh: Ví dụ, khi sắt tác dụng với axit clohidric (HCl) hoặc axit sulfuric loãng (H₂SO₄ loãng), nó sẽ tạo thành muối sắt(II) và giải phóng khí hidro (H₂).
- Fe + H₂SO₄ (loãng) → FeSO₄ + H₂
- Fe + 2HCl → FeCl₂ + H₂
- Phản ứng với dung dịch muối của kim loại yếu hơn: Sắt có thể đẩy các kim loại yếu hơn ra khỏi dung dịch muối của chúng, tạo thành muối sắt(II).
- Fe + CuSO₄ → FeSO₄ + Cu
- Fe + Pb(NO₃)₂ → Fe(NO₃)₂ + Pb
- Tác dụng với một số phi kim có tính oxi hóa yếu: Ví dụ, khi sắt tác dụng với lưu huỳnh (S), nó sẽ tạo thành sunfua sắt(II) (FeS).
- Fe + S → FeS
3.2 Điều Kiện Để Sắt Thể Hiện Hóa Trị III (Fe³⁺)
Sắt thường thể hiện hóa trị III trong các trường hợp sau:
- Tác dụng với axit có tính oxi hóa mạnh: Ví dụ, khi sắt tác dụng với axit nitric (HNO₃) đặc hoặc axit sulfuric đặc, nóng (H₂SO₄ đặc, nóng), nó sẽ tạo thành muối sắt(III), oxit nitơ (NO₂) hoặc lưu huỳnh đioxit (SO₂), và nước (H₂O).
- Fe + 6HNO₃ (đặc, nóng) → Fe(NO₃)₃ + 3NO₂ + 3H₂O
- 2Fe + 6H₂SO₄ (đặc, nóng) → Fe₂(SO₄)₃ + 3SO₂ + 6H₂O
- Tác dụng với các phi kim có tính oxi hóa mạnh: Ví dụ, khi sắt tác dụng với clo (Cl₂) hoặc flo (F₂), nó sẽ tạo thành clorua sắt(III) (FeCl₃) hoặc florua sắt(III) (FeF₃).
- 2Fe + 3Cl₂ → 2FeCl₃
- 2Fe + 3F₂ → 2FeF₃
- Oxi hóa hợp chất sắt(II) bằng chất oxi hóa mạnh: Các hợp chất sắt(II) có thể bị oxi hóa thành hợp chất sắt(III) bởi các chất oxi hóa mạnh như clo (Cl₂), kali pemanganat (KMnO₄), hoặc kali dicromat (K₂Cr₂O₇).
- 2FeCl₂ + Cl₂ → 2FeCl₃
- 10FeSO₄ + 2KMnO₄ + 8H₂SO₄ → 5Fe₂(SO₄)₃ + K₂SO₄ + 2MnSO₄ + 8H₂O
Theo một nghiên cứu của Viện Hóa học Việt Nam năm 2018, sự hình thành hóa trị III của sắt thường được ưu tiên trong môi trường có tính oxi hóa cao do sự ổn định tương đối của cấu hình electron 3d⁵.
4. Ứng Dụng Của Các Hợp Chất Sắt Trong Đời Sống Và Công Nghiệp
Các hợp chất của sắt đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp, nhờ vào tính chất hóa học và vật lý đa dạng của chúng.
4.1 Trong Y Học
- Sắt(II) sulfat (FeSO₄): Được sử dụng rộng rãi trong điều trị và phòng ngừa thiếu máu do thiếu sắt. Sắt là thành phần thiết yếu của hemoglobin, protein vận chuyển oxy trong máu.
- Sắt(III) hidroxit polymaltose: Một dạng sắt hữu cơ được sử dụng trong điều trị thiếu máu, dễ hấp thụ hơn và ít gây tác dụng phụ hơn so với sắt(II) sulfat.
4.2 Trong Nông Nghiệp
- Sắt(II) sulfat (FeSO₄): Được sử dụng làm phân bón vi lượng để cung cấp sắt cho cây trồng, đặc biệt là trong đất kiềm, nơi sắt khó hấp thụ.
- Chelat sắt: Các hợp chất chelat của sắt giúp tăng khả năng hòa tan và hấp thụ sắt của cây trồng, ngăn ngừa hiện tượng thiếu sắt ở cây.
4.3 Trong Công Nghiệp
- Oxit sắt(III) (Fe₂O₃): Được sử dụng làm chất tạo màu trong sản xuất sơn, gốm sứ, và vật liệu xây dựng. Nó cũng là thành phần quan trọng trong sản xuất thép.
- Clorua sắt(III) (FeCl₃): Được sử dụng làm chất keo tụ trong xử lý nước thải, giúp loại bỏ các chất rắn lơ lửng và các chất ô nhiễm khác.
- Sắt(II) clorua (FeCl₂): Được sử dụng làm chất khử trong nhiều quy trình công nghiệp, cũng như trong sản xuất thuốc nhuộm và mực in.
4.4 Trong Đời Sống Hàng Ngày
- Sắt: Là vật liệu chính để sản xuất thép, được sử dụng trong xây dựng, sản xuất ô tô, đồ gia dụng, và nhiều ứng dụng khác.
- Các hợp chất sắt: Được sử dụng trong sản xuất pin, nam châm, và các thiết bị điện tử.
Theo số liệu thống kê của Tổng cục Thống kê năm 2022, ngành công nghiệp luyện kim và sản xuất các sản phẩm từ sắt thép đóng góp khoảng 5% vào tổng sản phẩm quốc nội (GDP) của Việt Nam.
5. Phân Biệt Hợp Chất Sắt(II) Và Sắt(III) Bằng Phương Pháp Hóa Học
Để phân biệt các hợp chất sắt(II) và sắt(III), chúng ta có thể sử dụng một số thuốc thử hóa học đặc trưng, dựa trên sự khác biệt về tính chất hóa học của hai loại ion này.
5.1 Sử Dụng Dung Dịch Kiềm (NaOH Hoặc KOH)
- Với hợp chất sắt(II): Khi thêm dung dịch kiềm vào dung dịch chứa ion Fe²⁺, sẽ tạo thành kết tủa màu trắng xanh (Fe(OH)₂). Kết tủa này dễ bị oxi hóa bởi oxy trong không khí, chuyển dần sang màu nâu đỏ của Fe(OH)₃.
- Fe²⁺ + 2OH⁻ → Fe(OH)₂ (trắng xanh)
- 4Fe(OH)₂ + O₂ + 2H₂O → 4Fe(OH)₃ (nâu đỏ)
- Với hợp chất sắt(III): Khi thêm dung dịch kiềm vào dung dịch chứa ion Fe³⁺, sẽ tạo thành kết tủa màu nâu đỏ (Fe(OH)₃).
- Fe³⁺ + 3OH⁻ → Fe(OH)₃ (nâu đỏ)
5.2 Sử Dụng Dung Dịch Kali Ferixyanua (K₃[Fe(CN)₆])
- Với hợp chất sắt(II): Khi thêm dung dịch kali ferixyanua vào dung dịch chứa ion Fe²⁺, sẽ tạo thành kết tủa màu xanh đậm (xanh Turnbull).
- 3Fe²⁺ + 2[Fe(CN)₆]³⁻ → Fe₃[Fe(CN)₆]₂ (xanh Turnbull)
- Với hợp chất sắt(III): Không có phản ứng rõ ràng.
5.3 Sử Dụng Dung Dịch Kali Tiosyanat (KSCN)
- Với hợp chất sắt(III): Khi thêm dung dịch kali tiosyanat vào dung dịch chứa ion Fe³⁺, sẽ tạo thành dung dịch có màu đỏ máu do tạo phức chất [Fe(SCN)]²⁺.
- Fe³⁺ + SCN⁻ → [Fe(SCN)]²⁺ (đỏ máu)
- Với hợp chất sắt(II): Không có phản ứng rõ ràng.
Bảng Tóm Tắt Các Phản Ứng Phân Biệt:
| Thuốc thử | Hợp chất sắt(II) (Fe²⁺) | Hợp chất sắt(III) (Fe³⁺) |
|---|---|---|
| Dung dịch kiềm | Kết tủa trắng xanh, chuyển nâu đỏ trong không khí | Kết tủa nâu đỏ |
| K₃[Fe(CN)₆] | Kết tủa xanh đậm (xanh Turnbull) | Không phản ứng |
| Dung dịch KSCN | Không phản ứng | Dung dịch màu đỏ máu |
6. Câu Hỏi Thường Gặp Về Hóa Trị Của Sắt
Dưới đây là một số câu hỏi thường gặp liên quan đến hóa trị của sắt và các hợp chất của nó:
- Sắt có thể có hóa trị nào khác ngoài +2 và +3 không?
- Ngoài +2 và +3, sắt còn có thể có các hóa trị khác như +4, +5, và +6, nhưng chúng rất hiếm gặp và chỉ tồn tại trong một số điều kiện đặc biệt hoặc trong các phức chất đặc biệt.
- Tại sao sắt dễ bị gỉ sét?
- Sắt dễ bị gỉ sét do nó phản ứng với oxy và nước trong không khí, tạo thành oxit sắt(III) hidrat hóa (gỉ sét), có công thức gần đúng là Fe₂O₃.nH₂O.
- Làm thế nào để bảo vệ sắt khỏi bị gỉ sét?
- Có nhiều cách để bảo vệ sắt khỏi bị gỉ sét, bao gồm sơn, mạ kẽm, mạ crom, hoặc sử dụng các chất ức chế ăn mòn.
- Sắt có vai trò gì trong cơ thể con người?
- Sắt là một nguyên tố vi lượng thiết yếu, đóng vai trò quan trọng trong vận chuyển oxy, sản xuất năng lượng, và chức năng miễn dịch.
- Thiếu sắt có thể gây ra bệnh gì?
- Thiếu sắt có thể gây ra thiếu máu do thiếu sắt, một tình trạng phổ biến gây mệt mỏi, suy nhược, và các vấn đề sức khỏe khác.
- Những loại thực phẩm nào giàu sắt?
- Các loại thực phẩm giàu sắt bao gồm thịt đỏ, gan, hải sản, đậu, rau xanh đậm, và ngũ cốc tăng cường sắt.
- Hợp chất nào của sắt được sử dụng trong nam châm?
- Oxit sắt(II,III) (Fe₃O₄), còn gọi là magnetit, là một oxit sắt từ được sử dụng trong sản xuất nam châm.
- Sắt có độc hại không?
- Sắt là một nguyên tố thiết yếu, nhưng quá liều sắt có thể gây độc hại. Ngộ độc sắt cấp tính có thể gây tổn thương gan, tim, và các cơ quan khác.
- Làm thế nào để xử lý ngộ độc sắt?
- Ngộ độc sắt cần được điều trị y tế ngay lập tức. Các phương pháp điều trị có thể bao gồm rửa dạ dày, sử dụng chất chelat sắt, và truyền máu.
- Sắt có ảnh hưởng đến môi trường không?
- Các hoạt động khai thác và chế biến sắt có thể gây ô nhiễm môi trường, đặc biệt là ô nhiễm nước và không khí. Cần có các biện pháp kiểm soát ô nhiễm hiệu quả để giảm thiểu tác động tiêu cực đến môi trường.
7. Tìm Hiểu Thêm Tại CAUHOI2025.EDU.VN
Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về hóa trị của sắt và các ứng dụng của nó. Nếu bạn còn bất kỳ thắc mắc nào hoặc muốn tìm hiểu thêm về các chủ đề hóa học khác, hãy truy cập CAUHOI2025.EDU.VN để khám phá thêm nhiều thông tin hữu ích.
Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Câu trả lời chi tiết và dễ hiểu: Cho mọi thắc mắc về hóa học, vật lý, sinh học, và nhiều lĩnh vực khác.
- Thông tin đáng tin cậy: Được tổng hợp và kiểm chứng từ các nguồn uy tín.
- Lời khuyên và hướng dẫn: Giúp bạn giải quyết các vấn đề học tập và cuộc sống.
Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để mở rộng kiến thức và tìm thấy câu trả lời bạn cần!
Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại liên hệ với chúng tôi theo địa chỉ:
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN
Chúng tôi luôn sẵn lòng hỗ trợ bạn!

