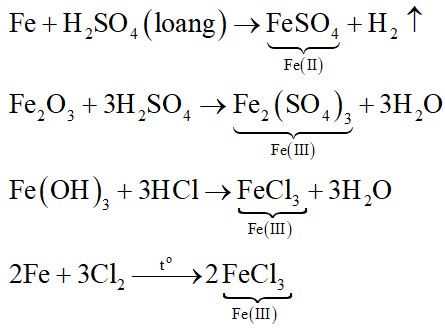Kim Loại Nào Sau Đây Không Tan Trong Dung Dịch HCl Dư? Giải Đáp Chi Tiết
Bạn đang thắc mắc “Kim Loại Nào Sau đây Không Tan Trong Dung Dịch Hcl Dư?” Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp câu trả lời chi tiết, dễ hiểu, cùng các kiến thức bổ trợ để bạn nắm vững vấn đề này. Chúng tôi sẽ đi sâu vào tính chất hóa học của các kim loại phổ biến và giải thích tại sao một số kim loại không phản ứng với axit clohydric (HCl). Ngoài ra, bài viết còn cung cấp các ví dụ thực tế, ứng dụng và các lưu ý quan trọng.
Đoạn giới thiệu (Meta Description)
“Kim loại nào sau đây không tan trong dung dịch HCl dư?” là câu hỏi thường gặp trong hóa học. CAUHOI2025.EDU.VN sẽ giải đáp chi tiết, cung cấp kiến thức về tính chất hóa học của kim loại và axit, đồng thời đưa ra ví dụ minh họa. Khám phá ngay để hiểu rõ hơn về dãy điện hóa kim loại, phản ứng oxi hóa khử và tính ăn mòn kim loại.
1. Kim Loại Nào Không Tan Trong Dung Dịch HCl Dư?
Câu trả lời chính xác là đồng (Cu). Đồng là một kim loại kém hoạt động và không có khả năng phản ứng với axit clohydric loãng (HCl).
1.1. Giải thích chi tiết
Để hiểu rõ tại sao đồng không tan trong HCl, chúng ta cần xem xét dãy điện hóa của kim loại và cơ chế phản ứng.
1.1.1. Dãy điện hóa của kim loại
Dãy điện hóa của kim loại là một dãy sắp xếp các kim loại theo thế điện cực chuẩn của chúng. Các kim loại đứng trước hydro (H) trong dãy điện hóa có khả năng khử ion H+ thành khí hydro (H2), tức là có thể tan trong dung dịch axit như HCl. Ngược lại, các kim loại đứng sau hydro, như đồng (Cu), không có khả năng này.
1.1.2. Cơ chế phản ứng
Phản ứng giữa kim loại và axit HCl là một phản ứng oxi hóa khử, trong đó:
- Kim loại (M) bị oxi hóa, mất electron để trở thành ion kim loại (M^n+).
- Ion hydro (H+) trong axit HCl bị khử, nhận electron để tạo thành khí hydro (H2).
Phản ứng tổng quát có thể được biểu diễn như sau:
M + nHCl → MCln + n/2 H2
Tuy nhiên, phản ứng này chỉ xảy ra khi kim loại có tính khử mạnh hơn hydro. Đồng (Cu) có tính khử yếu hơn hydro, do đó không thể khử ion H+ và không tan trong HCl.
1.2. Các kim loại khác phản ứng với HCl
Các kim loại đứng trước hydro trong dãy điện hóa, như kẽm (Zn), sắt (Fe), nhôm (Al), magie (Mg),… có thể tan trong dung dịch HCl.
Ví dụ:
- Kẽm phản ứng với HCl: Zn + 2HCl → ZnCl2 + H2
- Sắt phản ứng với HCl: Fe + 2HCl → FeCl2 + H2
2. Tại Sao Đồng (Cu) Không Phản Ứng Với HCl?
2.1. Thế điện cực chuẩn của đồng
Thế điện cực chuẩn của đồng (Cu^2+/Cu) là +0.34V, cao hơn so với thế điện cực chuẩn của hydro (2H+/H2) là 0.00V. Điều này có nghĩa là đồng khó bị oxi hóa hơn hydro.
2.2. Năng lượng hoạt hóa cao
Phản ứng giữa kim loại và axit HCl cần một năng lượng hoạt hóa nhất định để phá vỡ các liên kết trong kim loại và axit. Đối với đồng, năng lượng hoạt hóa này cao hơn so với các kim loại khác, làm cho phản ứng khó xảy ra hơn.
2.3. Sự hình thành lớp màng bảo vệ (trong một số điều kiện)
Trong một số điều kiện nhất định, đồng có thể tạo thành một lớp màng oxit mỏng trên bề mặt, ngăn chặn sự tiếp xúc giữa đồng và axit HCl. Tuy nhiên, lớp màng này thường không bền và dễ bị phá vỡ.
3. Các yếu tố ảnh hưởng đến khả năng phản ứng của kim loại với HCl
3.1. Nồng độ axit
Nồng độ axit HCl càng cao, khả năng phản ứng với kim loại càng mạnh. Tuy nhiên, ngay cả khi sử dụng HCl đặc, đồng vẫn không tan.
3.2. Nhiệt độ
Nhiệt độ cao có thể làm tăng tốc độ phản ứng hóa học. Tuy nhiên, việc tăng nhiệt độ cũng không đủ để đồng tan trong HCl.
3.3. Sự có mặt của chất xúc tác
Một số chất xúc tác có thể làm tăng tốc độ phản ứng hóa học. Tuy nhiên, không có chất xúc tác nào được biết đến có thể giúp đồng tan trong HCl.
4. So sánh khả năng phản ứng của các kim loại phổ biến với HCl
Để làm rõ hơn, chúng ta hãy so sánh khả năng phản ứng của một số kim loại phổ biến với HCl:
| Kim loại | Ký hiệu | Phản ứng với HCl | Giải thích |
|---|---|---|---|
| Kali | K | Có, rất mạnh | Kim loại kiềm, tính khử rất mạnh |
| Natri | Na | Có, mạnh | Kim loại kiềm, tính khử mạnh |
| Magie | Mg | Có, mạnh | Kim loại kiềm thổ, tính khử mạnh |
| Nhôm | Al | Có, chậm (tạo lớp oxit bảo vệ) | Tạo lớp oxit Al2O3 bảo vệ |
| Kẽm | Zn | Có, dễ dàng | Tính khử mạnh hơn hydro |
| Sắt | Fe | Có, dễ dàng | Tính khử mạnh hơn hydro |
| Chì | Pb | Có, chậm | Tạo lớp muối chì khó tan |
| Đồng | Cu | Không | Tính khử yếu hơn hydro |
| Bạc | Ag | Không | Tính khử yếu hơn hydro |
| Vàng | Au | Không | Kim loại quý, trơ về mặt hóa học |
| Platin | Pt | Không | Kim loại quý, trơ về mặt hóa học |
5. Trường hợp đồng có thể tan trong axit
Mặc dù đồng không tan trong HCl loãng, nhưng nó có thể tan trong một số loại axit khác, đặc biệt là axit có tính oxi hóa mạnh.
5.1. Axit nitric (HNO3)
Đồng tan trong axit nitric (HNO3) vì HNO3 là một chất oxi hóa mạnh, có khả năng oxi hóa đồng thành ion Cu^2+. Phản ứng xảy ra như sau:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (nếu HNO3 đặc)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (nếu HNO3 loãng)
Alt text: Phản ứng giữa đồng và axit nitric đặc tạo ra khí màu nâu đỏ NO2
5.2. Axit sulfuric đặc, nóng (H2SO4)
Đồng cũng có thể tan trong axit sulfuric đặc, nóng (H2SO4) vì H2SO4 đặc, nóng có tính oxi hóa mạnh. Phản ứng xảy ra như sau:
Cu + 2H2SO4 (đặc, nóng) → CuSO4 + SO2 + 2H2O
5.3. Nước cường toan (aqua regia)
Nước cường toan là hỗn hợp của axit nitric đặc và axit clohydric đặc theo tỷ lệ 1:3. Nước cường toan có khả năng hòa tan cả vàng và platin, những kim loại trơ nhất. Đồng cũng có thể tan trong nước cường toan.
Phản ứng xảy ra phức tạp, nhưng có thể hiểu đơn giản như sau: axit nitric có vai trò oxi hóa đồng thành ion Cu^2+, còn axit clohydric tạo phức với ion Cu^2+, làm giảm nồng độ ion Cu^2+ trong dung dịch, thúc đẩy phản ứng xảy ra.
6. Ứng dụng của phản ứng giữa kim loại và axit
6.1. Tẩy rửa kim loại
Axit HCl được sử dụng để tẩy rửa bề mặt kim loại, loại bỏ lớp oxit hoặc các chất bẩn khác.
6.2. Sản xuất muối kim loại
Phản ứng giữa kim loại và axit HCl được sử dụng để sản xuất các muối kim loại, ví dụ như ZnCl2, FeCl2,… Các muối này có nhiều ứng dụng trong công nghiệp và phòng thí nghiệm.
6.3. Phân tích hóa học
Phản ứng giữa kim loại và axit HCl được sử dụng trong phân tích hóa học để định tính và định lượng kim loại.
6.4. Điều chế hydro
Phản ứng giữa kim loại và axit HCl là một phương pháp đơn giản để điều chế khí hydro trong phòng thí nghiệm.
7. Lưu ý khi sử dụng axit HCl
Axit HCl là một hóa chất nguy hiểm, cần được sử dụng cẩn thận.
7.1. An toàn lao động
Khi làm việc với axit HCl, cần đeo kính bảo hộ, găng tay và áo choàng để bảo vệ mắt và da.
7.2. Thông gió
Cần làm việc trong môi trường thông gió tốt để tránh hít phải khí HCl.
7.3. Xử lý sự cố
Nếu axit HCl bắn vào mắt hoặc da, cần rửa ngay bằng nhiều nước và đến cơ sở y tế gần nhất.
7.4. Lưu trữ
Axit HCl cần được lưu trữ trong bình chứa kín, ở nơi khô ráo, thoáng mát và tránh xa các chất dễ cháy nổ.
8. Các câu hỏi thường gặp (FAQ)
Câu 1: Tại sao nhôm (Al) phản ứng chậm với HCl?
Nhôm phản ứng chậm với HCl do trên bề mặt nhôm có một lớp oxit Al2O3 rất bền vững. Lớp oxit này bảo vệ nhôm khỏi sự ăn mòn của axit. Khi nhôm tiếp xúc với HCl, lớp oxit này sẽ phản ứng trước, sau đó nhôm mới bắt đầu phản ứng.
Câu 2: Kim loại nào phản ứng mạnh nhất với HCl?
Các kim loại kiềm như kali (K) và natri (Na) phản ứng mạnh nhất với HCl. Phản ứng xảy ra rất nhanh và tỏa nhiệt lớn, có thể gây nổ.
Câu 3: Có thể dùng axit HCl để làm sạch đồ trang sức bằng bạc (Ag) không?
Không, không nên dùng axit HCl để làm sạch đồ trang sức bằng bạc. Bạc không tan trong HCl, nhưng HCl có thể làm hỏng một số thành phần khác trong đồ trang sức.
Câu 4: Tại sao vàng (Au) không tan trong HCl?
Vàng là một kim loại quý, rất trơ về mặt hóa học. Vàng có thế điện cực chuẩn rất cao, khó bị oxi hóa, do đó không tan trong HCl.
Câu 5: Nước cường toan là gì và tại sao nó có thể hòa tan vàng?
Nước cường toan là hỗn hợp của axit nitric đặc và axit clohydric đặc theo tỷ lệ 1:3. Axit nitric oxi hóa vàng thành ion Au^3+, còn axit clohydric tạo phức với ion Au^3+, làm giảm nồng độ ion Au^3+ trong dung dịch, thúc đẩy phản ứng xảy ra.
Câu 6: Phản ứng giữa kim loại và axit HCl có phải là phản ứng oxi hóa khử không?
Đúng, phản ứng giữa kim loại và axit HCl là một phản ứng oxi hóa khử. Trong phản ứng này, kim loại bị oxi hóa (mất electron) và ion hydro trong axit HCl bị khử (nhận electron).
Câu 7: Tại sao chì (Pb) phản ứng chậm với HCl?
Chì phản ứng chậm với HCl vì tạo thành lớp muối chì clorua (PbCl2) khó tan trên bề mặt kim loại, ngăn cản phản ứng tiếp tục.
Câu 8: Axit HCl có ăn mòn kim loại không?
Có, axit HCl có tính ăn mòn kim loại. Các kim loại đứng trước hydro trong dãy điện hóa sẽ bị ăn mòn bởi axit HCl.
Câu 9: Làm thế nào để nhận biết một kim loại có tan trong HCl hay không?
Để biết một kim loại có tan trong HCl hay không, bạn có thể dựa vào dãy điện hóa của kim loại. Nếu kim loại đứng trước hydro trong dãy điện hóa, nó sẽ tan trong HCl.
Câu 10: Có thể dùng axit HCl để tẩy gỉ sét (Fe2O3) không?
Có, axit HCl có thể dùng để tẩy gỉ sét. Gỉ sét là oxit sắt (Fe2O3), phản ứng với HCl tạo thành muối sắt và nước.
9. Kết luận
Như vậy, đồng (Cu) là một trong những kim loại phổ biến không tan trong dung dịch HCl dư do có tính khử yếu hơn hydro. Việc hiểu rõ dãy điện hóa của kim loại và cơ chế phản ứng oxi hóa khử giúp chúng ta giải thích được tính chất này. Hy vọng bài viết này của CAUHOI2025.EDU.VN đã cung cấp cho bạn những thông tin hữu ích và dễ hiểu.
Nếu bạn có bất kỳ thắc mắc nào khác, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để tìm kiếm câu trả lời hoặc đặt câu hỏi trực tiếp. Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng hỗ trợ bạn.
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN