**Công Thức Chung Anken: Tổng Quan Chi Tiết Nhất 2024 Từ A-Z**
Bạn đang tìm kiếm Công Thức Chung Anken và những thông tin liên quan? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp cho bạn kiến thức đầy đủ nhất về anken, từ công thức tổng quát, cấu tạo, tính chất hóa học, vật lý đến ứng dụng và điều chế, giúp bạn nắm vững kiến thức một cách dễ dàng và hiệu quả.
1. Anken Là Gì? Định Nghĩa Chi Tiết Nhất
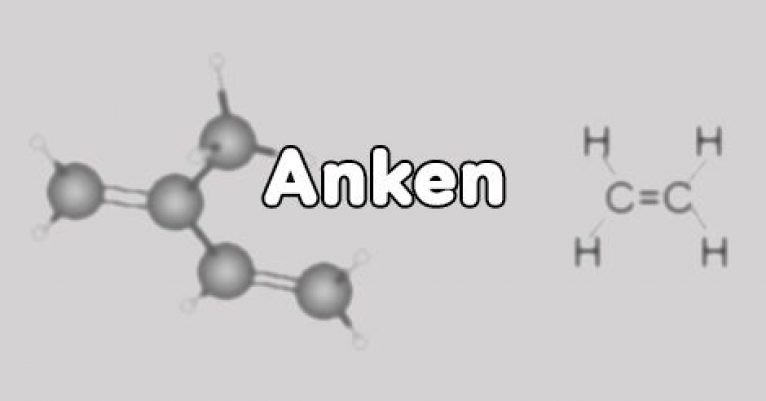
Anken, còn được gọi là olefin, là một loại hydrocacbon không no, mạch hở. Đặc điểm nổi bật của anken là trong phân tử của chúng có chứa ít nhất một liên kết đôi C=C, còn lại là các liên kết đơn. Theo định nghĩa từ Sách giáo khoa Hóa học 11 (Nhà xuất bản Giáo dục Việt Nam), anken có vai trò quan trọng trong nhiều phản ứng hóa học hữu cơ.

2. Công Thức Chung Anken và Cấu Tạo Phân Tử
2.1. Công Thức Tổng Quát Anken (Công Thức Chung)
Công thức chung anken: CnH2n (với n ≥ 2). Công thức này cho biết tỷ lệ giữa số nguyên tử cacbon và hydro trong phân tử anken.
Ví dụ: Eten (C2H4), propen (C3H6), buten (C4H8)…
2.2. Cấu Tạo Phân Tử Anken
- Liên kết đôi C=C: Liên kết đôi này gồm một liên kết sigma (σ) bền vững và một liên kết pi (π) kém bền hơn. Liên kết pi dễ bị phá vỡ trong các phản ứng hóa học, làm cho anken trở nên hoạt động hơn so với ankan.
- Cấu trúc phẳng: Các nguyên tử cacbon tham gia liên kết đôi và các nguyên tử liên kết trực tiếp với chúng nằm trên cùng một mặt phẳng.
3. Cách Gọi Tên Anken Theo IUPAC và Tên Thường
3.1. Tên Thay Thế (Tên IUPAC)
Tên thay thế của anken được hình thành theo quy tắc sau:
[Số chỉ vị trí nhánh]-[Tên nhánh]-[Tên mạch chính]-Số chỉ vị trí liên kết đôi-en
- Chọn mạch chính: Là mạch cacbon dài nhất chứa liên kết đôi.
- Đánh số mạch chính: Bắt đầu từ đầu mạch gần liên kết đôi hơn, sao cho số chỉ vị trí liên kết đôi là nhỏ nhất.
- Gọi tên nhánh: Theo thứ tự bảng chữ cái.
- Số chỉ vị trí: Đặt trước tên nhánh và trước đuôi “en”.
Ví dụ:
- CH2=CH-CH2-CH3: But-1-en
- CH3-CH=CH-CH3: But-2-en
- CH3-CH(CH3)-CH=CH2: 3-metylbut-1-en
3.2. Tên Thường
Tên thường của anken được hình thành bằng cách thay đổi đuôi “an” của ankan tương ứng bằng đuôi “ilen”.
Ví dụ:
- CH2=CH2: Etilen (từ etan)
- CH3-CH=CH2: Propilen (từ propan)
4. Tính Chất Vật Lý Của Anken: Điểm Nóng Chảy, Điểm Sôi, Độ Tan
- Trạng thái: Ở điều kiện thường, các anken từ C2 đến C4 tồn tại ở trạng thái khí, từ C5 trở đi là chất lỏng hoặc rắn.
- Nhiệt độ sôi và nhiệt độ nóng chảy: Nhiệt độ sôi và nhiệt độ nóng chảy của anken tăng dần khi số lượng nguyên tử cacbon trong phân tử tăng lên do sự tăng tương tác van der Waals giữa các phân tử.
- Độ tan: Anken nhẹ hơn nước và ít tan trong nước, nhưng tan tốt trong các dung môi hữu cơ như rượu, ete,… Theo một nghiên cứu của Đại học Khoa học Tự nhiên TP.HCM, độ tan của anken trong nước giảm khi mạch cacbon tăng lên.
5. Tính Chất Hóa Học Của Anken: Phản Ứng Cộng, Trùng Hợp, Oxi Hóa
Tính chất hóa học đặc trưng của anken là các phản ứng cộng vào liên kết đôi C=C.
5.1. Phản Ứng Cộng (Cộng H2, Halogen, HX, H2O)
Do có liên kết π kém bền, anken dễ dàng tham gia các phản ứng cộng.
5.1.1. Cộng Hydro (Hiđro hóa)
Anken cộng với hydro (H2) tạo thành ankan, cần xúc tác Ni, Pt hoặc Pd và nhiệt độ.
Phương trình tổng quát:
CnH2n + H2 → CnH2n+2 (xúc tác Ni, t°)
Ví dụ: CH2=CH2 + H2 → CH3-CH3 (xúc tác Ni, t°)
5.1.2. Cộng Halogen (Halogen hóa)
Anken tác dụng với halogen (Cl2, Br2) tạo thành dẫn xuất đihalogen. Phản ứng này làm mất màu dung dịch brom, được dùng để nhận biết anken.
Phương trình tổng quát:
CnH2n + X2 → CnH2nX2 (X là Cl hoặc Br)
Ví dụ: CH2=CH2 + Br2 → CH2Br-CH2Br
5.1.3. Cộng Hydro Halogenua (HX)
Anken tác dụng với hydro halogenua (HCl, HBr, HI) tạo thành dẫn xuất halogen. Phản ứng này tuân theo quy tắc Markovnikov: “Trong phản ứng cộng HX vào anken bất đối xứng, nguyên tử hydro (H) ưu tiên cộng vào nguyên tử cacbon mang nhiều hydro hơn, còn nguyên tử halogen (X) cộng vào nguyên tử cacbon mang ít hydro hơn”.
Phương trình tổng quát:
CnH2n + HX → CnH2n+1X (X là Cl, Br hoặc I)
Ví dụ:
CH3-CH=CH2 + HBr → CH3-CHBr-CH3 (sản phẩm chính)
CH3-CH=CH2 + HBr → CH3-CH2-CH2Br (sản phẩm phụ)
5.1.4. Cộng Nước (Hiđrat hóa)
Anken tác dụng với nước (H2O) tạo thành ancol, cần xúc tác axit (H+) và nhiệt độ. Phản ứng này cũng tuân theo quy tắc Markovnikov.
Phương trình tổng quát:
CnH2n + H2O → CnH2n+1OH (xúc tác H+, t°)
Ví dụ:
CH2=CH2 + H2O → CH3-CH2OH (xúc tác H+, t°)
CH3-CH=CH2 + H2O → CH3-CHOH-CH3 (sản phẩm chính)
CH3-CH=CH2 + H2O → CH3-CH2-CH2OH (sản phẩm phụ)
5.2. Phản Ứng Trùng Hợp
Nhiều phân tử anken có thể kết hợp với nhau tạo thành một phân tử lớn gọi là polime. Phản ứng này gọi là phản ứng trùng hợp, cần xúc tác, nhiệt độ và áp suất.
Phương trình tổng quát:
nCH2=CH2 → (-CH2-CH2-)n (xúc tác, t°, p)
Ví dụ:
nCH2=CH2 → (-CH2-CH2-)n (Polietilen – PE)
nCH2=CH(CH3) → (-CH2-CH(CH3)-)n (Polipropilen – PP)
Theo Viện Hóa học Công nghiệp Việt Nam, phản ứng trùng hợp anken có ý nghĩa quan trọng trong sản xuất vật liệu polyme.
5.3. Phản Ứng Oxi Hóa
5.3.1. Oxi Hóa Hoàn Toàn (Đốt Cháy)
Anken cháy hoàn toàn trong oxi tạo ra khí cacbon đioxit (CO2) và nước (H2O).
Phương trình tổng quát:
CnH2n + (3n/2)O2 → nCO2 + nH2O
Đặc điểm của phản ứng đốt cháy anken là số mol CO2 bằng số mol H2O.
5.3.2. Oxi Hóa Không Hoàn Toàn
- Với dung dịch KMnO4 (thuốc tím): Anken làm mất màu dung dịch thuốc tím, tạo thành glycol (diol) và MnO2. Phản ứng này được dùng để nhận biết anken.
Phương trình tổng quát:
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2
- Với oxi (O2) có xúc tác: Anken có thể bị oxi hóa thành các sản phẩm khác nhau tùy thuộc vào điều kiện phản ứng, ví dụ như anđehit, axit cacboxylic,…
6. Ứng Dụng Quan Trọng Của Anken Trong Đời Sống và Công Nghiệp
Anken có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất polime: Etilen dùng để sản xuất polietilen (PE), propilen dùng để sản xuất polipropilen (PP), là những vật liệu nhựa phổ biến.
- Sản xuất hóa chất: Anken là nguyên liệu để sản xuất nhiều hóa chất quan trọng như etanol, etylen oxit, vinyl clorua,…
- Sản xuất nhiên liệu: Một số anken được sử dụng làm nhiên liệu hoặc phụ gia nhiên liệu.
- Trong nông nghiệp: Etylen được sử dụng để kích thích sự chín của trái cây. Theo Bộ Nông nghiệp và Phát triển Nông thôn, việc sử dụng etylen giúp điều chỉnh thời gian thu hoạch và bảo quản nông sản.
7. Điều Chế Anken: Phương Pháp Trong Phòng Thí Nghiệm và Công Nghiệp
7.1. Trong Phòng Thí Nghiệm
- Dehidrat hóa ancol: Đun nóng ancol với axit sunfuric đặc (H2SO4) hoặc axit photphoric (H3PO4) để tách nước, tạo thành anken.
Phương trình tổng quát:
CnH2n+1OH → CnH2n + H2O (xúc tác H2SO4 đặc, t° > 170°C)
Ví dụ: C2H5OH → CH2=CH2 + H2O
- Dehalogen hóa dẫn xuất đihalogen: Cho dẫn xuất đihalogen tác dụng với kẽm (Zn) để loại bỏ halogen, tạo thành anken.
Phương trình tổng quát:
CnH2nX2 + Zn → CnH2n + ZnX2
7.2. Trong Công Nghiệp
- Cracking ankan: Nung nóng ankan mạch dài ở nhiệt độ cao với xúc tác để bẻ gãy mạch cacbon, tạo thành hỗn hợp các anken và ankan mạch ngắn hơn.
- Tách hydro từ ankan: Cho ankan đi qua xúc tác ở nhiệt độ cao để loại bỏ hydro, tạo thành anken.
- Từ khí đồng hành và khí cracking dầu mỏ: Tách etilen và các anken khác từ khí đồng hành và khí cracking dầu mỏ bằng phương pháp chưng cất phân đoạn.
8. Bài Tập Vận Dụng Về Công Thức Chung Anken (Có Đáp Án Chi Tiết)
Câu 1: Đốt cháy hoàn toàn 2.8 gam anken X thu được 8.8 gam CO2. Xác định công thức phân tử của X.
Giải:
nCO2 = 8.8/44 = 0.2 mol
CnH2n + (3n/2)O2 → nCO2 + nH2O
Từ phương trình, nX = nCO2/n = 0.2/n
MX = 2.8/(0.2/n) = 14n
Mà MX = 12n + 2n = 14n
Vậy 14n = 2.8/(0.2/n) => n = 4
Công thức phân tử của X là C4H8.
Câu 2: Cho 5.6 lít hỗn hợp X gồm etilen và propilen (đktc) tác dụng vừa đủ với dung dịch brom, thấy có 16 gam brom đã phản ứng. Tính phần trăm thể tích mỗi khí trong hỗn hợp X.
Giải:
Gọi số mol etilen là x, số mol propilen là y.
Ta có: x + y = 5.6/22.4 = 0.25 mol
CH2=CH2 + Br2 → CH2Br-CH2Br
x x
CH3-CH=CH2 + Br2 → CH3-CHBr-CH2Br
y y
nBr2 = x + y = 16/160 = 0.1 mol
Giải hệ phương trình:
x + y = 0.25
x + y = 0.1
=> x = 0.15 mol, y = 0.1 mol
%V(etilen) = (0.15/0.25) * 100% = 60%
%V(propilen) = (0.1/0.25) * 100% = 40%
Câu 3: Cho 4,48 lít hỗn hợp X gồm hai anken kế tiếp nhau trong dãy đồng đẳng lội qua bình đựng dung dịch brom dư, thấy khối lượng bình tăng thêm 9,8 gam. Xác định công thức phân tử của hai anken.
Giải:
Gọi công thức chung của hai anken là CnH2n
CnH2n + Br2 → CnH2nBr2
nCnH2n = 4.48/22.4 = 0.2 mol
Khối lượng bình tăng = khối lượng anken = 9.8 gam
MCnH2n = 9.8/0.2 = 49
14n = 49 => n = 3.5
Vậy hai anken là C3H6 và C4H8.
9. Câu Hỏi Thường Gặp Về Anken (FAQ)
Câu 1: Anken có đồng phân hình học không?
Trả lời: Có, anken có đồng phân hình học (cis-trans) khi mỗi nguyên tử cacbon của liên kết đôi liên kết với hai nhóm thế khác nhau.
Câu 2: Anken có làm mất màu dung dịch KMnO4 không?
Trả lời: Có, anken làm mất màu dung dịch KMnO4, đây là phản ứng dùng để nhận biết anken.
Câu 3: Anken có tan trong nước không?
Trả lời: Anken ít tan trong nước nhưng tan tốt trong các dung môi hữu cơ.
Câu 4: Phản ứng đặc trưng của anken là gì?
Trả lời: Phản ứng đặc trưng của anken là phản ứng cộng vào liên kết đôi C=C.
Câu 5: Anken có tác dụng với dung dịch NaOH không?
Trả lời: Anken không tác dụng với dung dịch NaOH.
Câu 6: Anken có làm đổi màu quỳ tím không?
Trả lời: Anken là hydrocacbon trung tính, không làm đổi màu quỳ tím.
Câu 7: Tại sao anken lại tham gia phản ứng cộng dễ dàng hơn ankan?
Trả lời: Do anken có liên kết π kém bền, dễ bị phá vỡ để tạo liên kết mới.
Câu 8: Polietilen (PE) được tạo ra từ anken nào?
Trả lời: Polietilen (PE) được tạo ra từ etilen (CH2=CH2).
Câu 9: Anken có ứng dụng gì trong nông nghiệp?
Trả lời: Etylen được sử dụng để kích thích sự chín của trái cây.
Câu 10: Điều kiện để anken tham gia phản ứng trùng hợp là gì?
Trả lời: Cần có xúc tác, nhiệt độ và áp suất thích hợp.
10. CAUHOI2025.EDU.VN – Nguồn Thông Tin Hóa Học Uy Tín Cho Bạn
Hy vọng bài viết này đã cung cấp cho bạn cái nhìn tổng quan và chi tiết về công thức chung anken. Nếu bạn có bất kỳ câu hỏi nào khác hoặc muốn tìm hiểu sâu hơn về hóa học, hãy truy cập CAUHOI2025.EDU.VN để khám phá thêm nhiều kiến thức hữu ích và được giải đáp tận tình.
Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Thông tin chính xác và đáng tin cậy: Các bài viết được biên soạn bởi đội ngũ chuyên gia và được kiểm chứng kỹ lưỡng.
- Giải thích dễ hiểu: Ngôn ngữ trình bày đơn giản, dễ tiếp cận, phù hợp với mọi đối tượng.
- Hỗ trợ tận tình: Đội ngũ tư vấn sẵn sàng giải đáp mọi thắc mắc của bạn.
Đừng ngần ngại liên hệ với chúng tôi nếu bạn cần bất kỳ sự hỗ trợ nào:
- Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
- Số điện thoại: +84 2435162967
- Trang web: CAUHOI2025.EDU.VN
Hãy truy cập CauHoi2025.EDU.VN ngay hôm nay để khám phá thế giới hóa học đầy thú vị và bổ ích!