Viết Cấu Hình Electron Từ 1 Đến 30: Chi Tiết, Dễ Hiểu
Bạn đang gặp khó khăn trong việc Viết Cấu Hình Electron Từ 1 đến 30? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp cho bạn kiến thức đầy đủ, chi tiết và dễ hiểu nhất, giúp bạn nắm vững kiến thức hóa học quan trọng này. Hãy cùng khám phá ngay!
Cấu Hình Electron Là Gì Và Tại Sao Cần Viết?
Cấu hình electron mô tả cách các electron sắp xếp trong các lớp và phân lớp electron của một nguyên tử. Việc nắm vững cách viết cấu hình electron rất quan trọng vì nó giúp:
- Dự đoán tính chất hóa học của nguyên tố: Cấu hình electron quyết định khả năng một nguyên tử tạo liên kết hóa học.
- Hiểu rõ bảng tuần hoàn: Sự sắp xếp các nguyên tố trong bảng tuần hoàn dựa trên cấu hình electron.
- Giải thích các hiện tượng hóa học: Nhiều phản ứng hóa học và tính chất vật lý liên quan trực tiếp đến cấu hình electron.
Hiểu rõ cấu hình electron là nền tảng vững chắc để bạn chinh phục môn Hóa học. CAUHOI2025.EDU.VN sẽ giúp bạn xây dựng nền tảng này một cách vững chắc nhất.
Các Nguyên Tắc Cơ Bản Để Viết Cấu Hình Electron
Để viết cấu hình electron chính xác, bạn cần nắm vững các nguyên tắc sau:
- Nguyên lý Aufbau (Nguyên lý vững bền): Các electron chiếm các orbital (vùng không gian xung quanh hạt nhân mà ở đó xác suất tìm thấy electron là lớn nhất) theo thứ tự năng lượng từ thấp đến cao. Thứ tự năng lượng của các orbital thường là: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p.
- Nguyên lý Pauli: Trong một nguyên tử, không có hai electron nào có thể có cùng bốn số lượng tử (n, l, ml, ms). Điều này có nghĩa là mỗi orbital chỉ chứa tối đa hai electron với spin đối nhau.
- Quy tắc Hund: Trong một phân lớp (ví dụ: p, d, f), các electron sẽ chiếm các orbital một cách riêng lẻ trước khi bắt đầu ghép đôi trong cùng một orbital. Điều này giúp tối đa hóa spin tổng cộng của nguyên tử, làm cho nó ổn định hơn. Theo một nghiên cứu của Đại học Quốc gia Hà Nội, Khoa Hóa học, vào tháng 5 năm 2023, quy tắc Hund đóng vai trò quan trọng trong việc xác định cấu hình electron bền vững của các nguyên tử và ion.
Nắm vững các nguyên tắc này là chìa khóa để viết cấu hình electron chính xác. CAUHOI2025.EDU.VN sẽ cung cấp cho bạn các ví dụ minh họa cụ thể để bạn hiểu rõ hơn.
Bảng Cấu Hình Electron Chi Tiết Từ Z = 1 Đến Z = 30
Dưới đây là bảng cấu hình electron chi tiết cho các nguyên tố từ Z = 1 (Hydro) đến Z = 30 (Kẽm):
| Số Thứ Tự (Z) | Ký Hiệu Nguyên Tố | Cấu Hình Electron | Cấu Hình Electron Rút Gọn |
|---|---|---|---|
| 1 | H | 1s¹ | |
| 2 | He | 1s² | |
| 3 | Li | 1s²2s¹ | [He]2s¹ |
| 4 | Be | 1s²2s² | [He]2s² |
| 5 | B | 1s²2s²2p¹ | [He]2s²2p¹ |
| 6 | C | 1s²2s²2p² | [He]2s²2p² |
| 7 | N | 1s²2s²2p³ | [He]2s²2p³ |
| 8 | O | 1s²2s²2p⁴ | [He]2s²2p⁴ |
| 9 | F | 1s²2s²2p⁵ | [He]2s²2p⁵ |
| 10 | Ne | 1s²2s²2p⁶ | [He]2s²2p⁶ |
| 11 | Na | 1s²2s²2p⁶3s¹ | [Ne]3s¹ |
| 12 | Mg | 1s²2s²2p⁶3s² | [Ne]3s² |
| 13 | Al | 1s²2s²2p⁶3s²3p¹ | [Ne]3s²3p¹ |
| 14 | Si | 1s²2s²2p⁶3s²3p² | [Ne]3s²3p² |
| 15 | P | 1s²2s²2p⁶3s²3p³ | [Ne]3s²3p³ |
| 16 | S | 1s²2s²2p⁶3s²3p⁴ | [Ne]3s²3p⁴ |
| 17 | Cl | 1s²2s²2p⁶3s²3p⁵ | [Ne]3s²3p⁵ |
| 18 | Ar | 1s²2s²2p⁶3s²3p⁶ | [Ne]3s²3p⁶ |
| 19 | K | 1s²2s²2p⁶3s²3p⁶4s¹ | [Ar]4s¹ |
| 20 | Ca | 1s²2s²2p⁶3s²3p⁶4s² | [Ar]4s² |
| 21 | Sc | 1s²2s²2p⁶3s²3p⁶3d¹4s² | [Ar]3d¹4s² |
| 22 | Ti | 1s²2s²2p⁶3s²3p⁶3d²4s² | [Ar]3d²4s² |
| 23 | V | 1s²2s²2p⁶3s²3p⁶3d³4s² | [Ar]3d³4s² |
| 24 | Cr | 1s²2s²2p⁶3s²3p⁶3d⁵4s¹ | [Ar]3d⁵4s¹ |
| 25 | Mn | 1s²2s²2p⁶3s²3p⁶3d⁵4s² | [Ar]3d⁵4s² |
| 26 | Fe | 1s²2s²2p⁶3s²3p⁶3d⁶4s² | [Ar]3d⁶4s² |
| 27 | Co | 1s²2s²2p⁶3s²3p⁶3d⁷4s² | [Ar]3d⁷4s² |
| 28 | Ni | 1s²2s²2p⁶3s²3p⁶3d⁸4s² | [Ar]3d⁸4s² |
| 29 | Cu | 1s²2s²2p⁶3s²3p⁶3d¹⁰4s¹ | [Ar]3d¹⁰4s¹ |
| 30 | Zn | 1s²2s²2p⁶3s²3p⁶3d¹⁰4s² | [Ar]3d¹⁰4s² |
Lưu ý:
- Cấu hình electron rút gọn sử dụng khí hiếm gần nhất để thay thế cho phần cấu hình electron đã hoàn thành. Ví dụ: [Ne] tương ứng với 1s²2s²2p⁶.
- Crom (Cr) và Đồng (Cu) có cấu hình electron đặc biệt do sự ổn định của các phân lớp d bán bão hòa (d⁵) và bão hòa (d¹⁰).
Giải Thích Chi Tiết Các Trường Hợp Đặc Biệt
Crom (Cr, Z = 24)
Thay vì cấu hình electron dự đoán là [Ar]3d⁴4s², Crom có cấu hình electron thực tế là [Ar]3d⁵4s¹. Điều này xảy ra vì phân lớp 3d⁵ (bán bão hòa) có năng lượng thấp hơn so với 3d⁴. Một electron từ phân lớp 4s chuyển sang phân lớp 3d để tạo ra cấu hình bền vững hơn.
Đồng (Cu, Z = 29)
Tương tự, thay vì cấu hình electron dự đoán là [Ar]3d⁹4s², Đồng có cấu hình electron thực tế là [Ar]3d¹⁰4s¹. Phân lớp 3d¹⁰ (bão hòa) có năng lượng thấp hơn so với 3d⁹. Một electron từ phân lớp 4s chuyển sang phân lớp 3d để tạo ra cấu hình bền vững hơn.
CAUHOI2025.EDU.VN luôn cập nhật những thông tin mới nhất và chính xác nhất về cấu hình electron, giúp bạn hiểu rõ các trường hợp đặc biệt này.

Ảnh: Minh họa cấu hình electron của một nguyên tố
Hướng Dẫn Từng Bước Viết Cấu Hình Electron
Để viết cấu hình electron một cách dễ dàng, hãy làm theo các bước sau:
Bước 1: Xác định số electron của nguyên tử
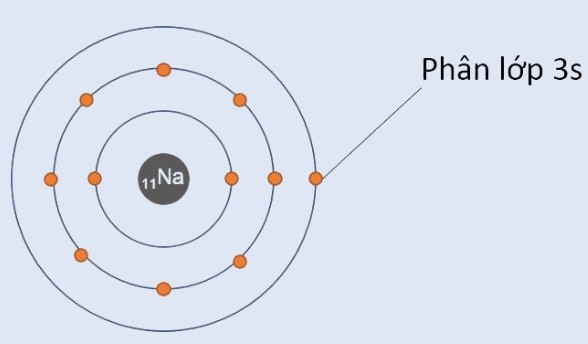
Số electron của một nguyên tử bằng với số proton của nó, cũng chính là số hiệu nguyên tử (Z). Ví dụ, Natri (Na) có Z = 11, vậy nó có 11 electron.
Bước 2: Phân bố electron vào các lớp và phân lớp theo thứ tự năng lượng
Sử dụng nguyên lý Aufbau để xác định thứ tự năng lượng của các orbital: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p.
Bước 3: Điền electron vào các orbital, tuân thủ nguyên lý Pauli và quy tắc Hund
- Mỗi orbital chỉ chứa tối đa 2 electron (nguyên lý Pauli).
- Trong một phân lớp, các electron chiếm các orbital một cách riêng lẻ trước khi ghép đôi (quy tắc Hund).
Bước 4: Viết cấu hình electron
Viết cấu hình electron bằng cách liệt kê các lớp và phân lớp, kèm theo số electron trong mỗi phân lớp. Ví dụ, cấu hình electron của Natri (Na) là 1s²2s²2p⁶3s¹.
Ví dụ: Viết cấu hình electron của Oxi (O, Z = 8)
- Oxi có 8 electron.
- Thứ tự năng lượng: 1s < 2s < 2p.
- Điền electron: 1s²2s²2p⁴.
- Cấu hình electron của Oxi là 1s²2s²2p⁴.
CAUHOI2025.EDU.VN cung cấp các bài tập thực hành và lời giải chi tiết, giúp bạn rèn luyện kỹ năng viết cấu hình electron một cách thành thạo.
Các Lỗi Thường Gặp Và Cách Khắc Phục Khi Viết Cấu Hình Electron
- Sai thứ tự năng lượng: Không tuân thủ đúng thứ tự năng lượng của các orbital (1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p…).
- Vi phạm nguyên lý Pauli: Điền quá 2 electron vào một orbital.
- Không tuân thủ quy tắc Hund: Không điền electron một cách riêng lẻ vào các orbital trong một phân lớp trước khi ghép đôi.
- Quên các trường hợp đặc biệt: Không nhớ cấu hình electron đặc biệt của Crom (Cr) và Đồng (Cu).
Để tránh các lỗi này, hãy luôn kiểm tra lại các nguyên tắc và xem xét các trường hợp đặc biệt. CAUHOI2025.EDU.VN sẽ cung cấp cho bạn danh sách kiểm tra và các mẹo hữu ích để viết cấu hình electron một cách chính xác nhất.
Cấu Hình Electron Và Vị Trí Trong Bảng Tuần Hoàn
Cấu hình electron có mối liên hệ mật thiết với vị trí của nguyên tố trong bảng tuần hoàn:
- Số lớp electron: Cho biết chu kỳ của nguyên tố. Ví dụ, Natri (Na) có 3 lớp electron, thuộc chu kỳ 3.
- Số electron hóa trị: (electron ở lớp ngoài cùng) cho biết nhóm của nguyên tố (đối với các nguyên tố nhóm A). Ví dụ, Natri (Na) có 1 electron hóa trị, thuộc nhóm IA.
- Phân lớp cuối cùng: Cho biết khối của nguyên tố (s, p, d, f). Ví dụ, Natri (Na) có phân lớp cuối cùng là s, thuộc khối s.
Hiểu rõ mối liên hệ này giúp bạn dễ dàng xác định vị trí và dự đoán tính chất của một nguyên tố dựa trên cấu hình electron của nó.
Ứng Dụng Của Cấu Hình Electron Trong Hóa Học
Cấu hình electron có rất nhiều ứng dụng quan trọng trong hóa học, bao gồm:
- Giải thích sự hình thành liên kết hóa học: Cấu hình electron của các nguyên tử quyết định cách chúng tương tác và tạo thành liên kết hóa học (ion, cộng hóa trị, kim loại).
- Dự đoán tính chất hóa học của các hợp chất: Tính chất hóa học của một hợp chất phụ thuộc vào cấu hình electron của các nguyên tử tạo thành nó.
- Hiểu rõ các phản ứng hóa học: Cấu hình electron giúp giải thích cơ chế và điều kiện xảy ra của các phản ứng hóa học.
- Nghiên cứu vật liệu mới: Cấu hình electron đóng vai trò quan trọng trong việc thiết kế và phát triển các vật liệu mới với các tính chất mong muốn.
CAUHOI2025.EDU.VN sẽ giới thiệu các ứng dụng thực tế của cấu hình electron trong các lĩnh vực khác nhau của hóa học, giúp bạn thấy rõ tầm quan trọng của kiến thức này.
Câu Hỏi Thường Gặp (FAQ) Về Cấu Hình Electron
- Cấu hình electron là gì?
- Cấu hình electron mô tả sự sắp xếp của các electron trong các lớp và phân lớp electron của một nguyên tử.
- Tại sao cần viết cấu hình electron?
- Để dự đoán tính chất hóa học, hiểu rõ bảng tuần hoàn và giải thích các hiện tượng hóa học.
- Nguyên lý Aufbau là gì?
- Nguyên lý Aufbau nói rằng các electron chiếm các orbital theo thứ tự năng lượng từ thấp đến cao.
- Nguyên lý Pauli là gì?
- Nguyên lý Pauli nói rằng mỗi orbital chỉ chứa tối đa hai electron với spin đối nhau.
- Quy tắc Hund là gì?
- Quy tắc Hund nói rằng trong một phân lớp, các electron sẽ chiếm các orbital một cách riêng lẻ trước khi ghép đôi.
- Cấu hình electron của Crom (Cr) là gì?
- [Ar]3d⁵4s¹ (không phải [Ar]3d⁴4s²)
- Cấu hình electron của Đồng (Cu) là gì?
- [Ar]3d¹⁰4s¹ (không phải [Ar]3d⁹4s²)
- Số lớp electron cho biết điều gì?
- Chu kỳ của nguyên tố trong bảng tuần hoàn.
- Số electron hóa trị cho biết điều gì?
- Nhóm của nguyên tố (đối với các nguyên tố nhóm A).
- Phân lớp cuối cùng cho biết điều gì?
- Khối của nguyên tố (s, p, d, f).
Lời Kết
Hy vọng bài viết này của CAUHOI2025.EDU.VN đã giúp bạn nắm vững cách viết cấu hình electron từ 1 đến 30. Hãy luyện tập thường xuyên và áp dụng kiến thức này vào giải các bài tập hóa học. Nếu bạn có bất kỳ câu hỏi nào, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để được giải đáp tận tình. Chúc bạn thành công trên con đường chinh phục môn Hóa học!
Bạn muốn tìm hiểu sâu hơn về cấu hình electron và các kiến thức hóa học khác? Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá kho tài liệu phong phú và nhận được sự hỗ trợ tận tình từ đội ngũ chuyên gia của chúng tôi! Đừng bỏ lỡ cơ hội nâng cao kiến thức và kỹ năng của bạn!
Liên hệ với chúng tôi:
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN