**Chất Nào Sau Đây Là Chất Điện Li Mạnh? Giải Thích Chi Tiết**
Bạn đang gặp khó khăn trong việc phân biệt chất điện li mạnh và yếu? CAUHOI2025.EDU.VN sẽ giúp bạn hiểu rõ về chất điện li mạnh, cách nhận biết và các ví dụ cụ thể để bạn nắm vững kiến thức này. Cùng khám phá ngay!
1. Chất Điện Li Là Gì?
Chất điện li là những chất khi hòa tan trong nước (hoặc ở trạng thái nóng chảy) thì phân li thành các ion. Quá trình này gọi là sự điện li. Các ion này (cation mang điện tích dương và anion mang điện tích âm) làm cho dung dịch có khả năng dẫn điện. Theo định nghĩa của IUPAC, chất điện li là chất tạo thành dung dịch dẫn điện khi hòa tan trong dung môi phân cực, chẳng hạn như nước.
1.1. Định Nghĩa Chi Tiết Về Chất Điện Li
Hiểu một cách đơn giản, chất điện li là chất có khả năng phân ly thành ion khi tan trong nước hoặc nóng chảy. Các ion này chính là các hạt mang điện, giúp dung dịch dẫn điện. Chất điện li thường là các hợp chất ion hoặc các hợp chất cộng hóa trị phân cực mạnh.
Ví dụ:
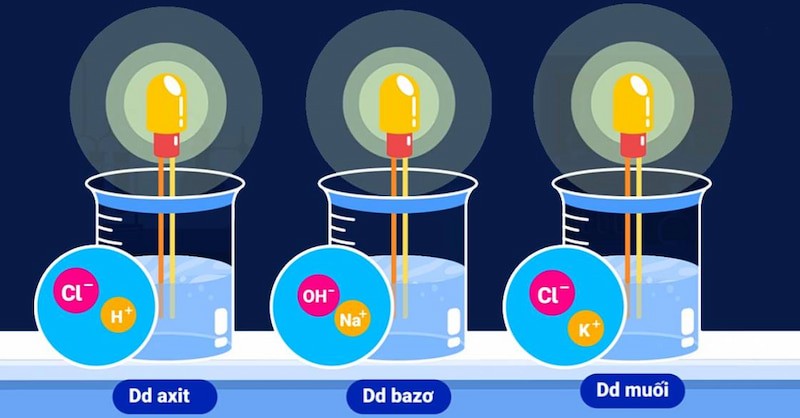
- NaCl (muối ăn) khi tan trong nước tạo thành ion Na+ và Cl-.
- HCl (axit clohidric) khi tan trong nước tạo thành ion H+ và Cl-.
1.2. Tính Chất Đặc Trưng Của Chất Điện Li
- Khả năng hòa tan: Đa số chất điện li tan được trong nước, một số ít chỉ tan một phần hoặc rất ít.
- Phân ly thành ion: Khi tan trong nước, các chất điện li phân ly thành các ion dương (cation) và ion âm (anion).
- Dẫn điện: Dung dịch chứa các ion này có khả năng dẫn điện.
- Phản ứng trao đổi ion: Tham gia vào các phản ứng hóa học theo cơ chế trao đổi ion.
1.3. Phân Loại Chất Điện Li
Chất điện li được chia thành hai loại chính: chất điện li mạnh và chất điện li yếu, dựa vào khả năng phân li thành ion của chúng.
2. Phân Biệt Chất Điện Li Mạnh và Chất Điện Li Yếu
Sự khác biệt chính giữa chất điện li mạnh và chất điện li yếu nằm ở khả năng phân li thành ion trong dung dịch.
2.1. Chất Điện Li Mạnh Là Gì?
Chất điện li mạnh là những chất khi tan trong nước, các phân tử hòa tan hoàn toàn phân li thành ion. Quá trình điện li của chất điện li mạnh được biểu diễn bằng mũi tên một chiều (→), chỉ ra rằng phản ứng diễn ra hoàn toàn.
Ví dụ về chất điện li mạnh:
- Các axit mạnh: HCl, H2SO4, HNO3, HClO4, HBr, HI.
- Các bazơ mạnh (kiềm): NaOH, KOH, Ca(OH)2, Ba(OH)2.
- Hầu hết các muối tan: NaCl, KCl, CuSO4, KNO3, Na2SO4.
Phương trình điện li của chất điện li mạnh:
- HCl (aq) → H+ (aq) + Cl- (aq)
- NaOH (aq) → Na+ (aq) + OH- (aq)
- NaCl (aq) → Na+ (aq) + Cl- (aq)

Ảnh minh họa sự điện li của chất điện li mạnh, phân ly hoàn toàn thành ion trong dung dịch
2.2. Chất Điện Li Yếu Là Gì?
Chất điện li yếu là những chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch. Quá trình điện li của chất điện li yếu là một quá trình thuận nghịch và được biểu diễn bằng mũi tên hai chiều (⇌).
Ví dụ về chất điện li yếu:
- Các axit yếu: CH3COOH (axit axetic), H2CO3 (axit cacbonic), H2S (axit sunfua), HF (axit flohidric), HNO2 (axit nitrơ), H3PO4 (axit photphoric).
- Các bazơ yếu: NH3 (amoniac), các hidroxit của kim loại ít tan như Mg(OH)2, Fe(OH)2, Cu(OH)2.
- Một số muối ít tan: AgCl, BaSO4.
Phương trình điện li của chất điện li yếu:
- CH3COOH (aq) ⇌ H+ (aq) + CH3COO- (aq)
- NH3 (aq) + H2O (l) ⇌ NH4+ (aq) + OH- (aq)
2.3. Bảng So Sánh Chất Điện Li Mạnh và Chất Điện Li Yếu
Để dễ dàng so sánh và ghi nhớ, bạn có thể tham khảo bảng sau:
| Đặc điểm | Chất điện li mạnh | Chất điện li yếu |
|---|---|---|
| Khả năng điện li | Phân li hoàn toàn thành ion trong dung dịch | Chỉ phân li một phần thành ion trong dung dịch |
| Mức độ dẫn điện | Dẫn điện tốt | Dẫn điện kém |
| Phương trình | Mũi tên một chiều (→) | Mũi tên hai chiều (⇌) |
| Ví dụ | HCl, NaOH, NaCl | CH3COOH, NH3, H2O |
| Độ điện li (α) | α ≈ 1 (hoặc gần 100%) | α << 1 (thường nhỏ hơn 10%) |
2.4. Độ Điện Li (α) – Thước Đo Mức Độ Điện Li
Độ điện li (α) là đại lượng đặc trưng cho mức độ điện li của một chất điện li yếu trong dung dịch. Nó được định nghĩa là tỉ số giữa số mol chất đã điện li (n điện li) và tổng số mol chất hòa tan (n hòa tan):
α = n điện li / n hòa tan
- α có giá trị từ 0 đến 1 (hoặc từ 0% đến 100%).
- Đối với chất điện li mạnh, α ≈ 1 (hoặc gần 100%).
- Đối với chất điện li yếu, α < 1 (thường nhỏ hơn 10%).
Độ điện li phụ thuộc vào nhiều yếu tố như:
- Bản chất của chất điện li: Mỗi chất có khả năng điện li khác nhau.
- Nhiệt độ: Nhiệt độ tăng thường làm tăng độ điện li.
- Nồng độ: Nồng độ tăng thường làm giảm độ điện li (đối với chất điện li yếu).
- Dung môi: Dung môi có độ phân cực cao (như nước) thường làm tăng độ điện li.
3. Ứng Dụng Của Chất Điện Li Trong Thực Tế
Chất điện li đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp.
3.1. Trong Y Học
- Dung dịch điện giải: Được sử dụng để bù nước và điện giải cho bệnh nhân mất nước do tiêu chảy, nôn mửa, hoặc hoạt động thể lực quá sức. Các dung dịch này thường chứa các ion Na+, K+, Cl-,…
- Thuốc tiêm truyền: Nhiều loại thuốc được bào chế dưới dạng dung dịch điện li để dễ dàng hấp thu vào cơ thể.
- Xét nghiệm: Chất điện li được sử dụng trong các xét nghiệm máu, nước tiểu để đánh giá chức năng của các cơ quan trong cơ thể.
3.2. Trong Nông Nghiệp
- Phân bón: Nhiều loại phân bón chứa các muối điện li (như KNO3, (NH4)2SO4) cung cấp các chất dinh dưỡng cần thiết cho cây trồng.
- Điều chỉnh độ pH của đất: Sử dụng các chất điện li như vôi (Ca(OH)2) để trung hòa độ chua của đất.
3.3. Trong Công Nghiệp
- Sản xuất hóa chất: Chất điện li được sử dụng làm chất xúc tác hoặc tham gia trực tiếp vào các phản ứng hóa học để sản xuất ra các hóa chất khác.
- Ắc quy và pin: Dung dịch điện li là thành phần không thể thiếu trong ắc quy và pin, giúp tạo ra dòng điện.
- Điện phân: Quá trình điện phân sử dụng chất điện li để tách các chất từ hợp chất của chúng. Ví dụ, điện phân dung dịch NaCl để sản xuất clo và hidro.
- Xử lý nước: Chất điện li được sử dụng để keo tụ các chất bẩn trong nước, giúp quá trình lọc nước hiệu quả hơn.
3.4. Trong Đời Sống Hàng Ngày
- Nước uống điện giải: Bổ sung các ion khoáng chất cần thiết cho cơ thể sau khi vận động.
- Chất tẩy rửa: Nhiều loại chất tẩy rửa chứa các chất điện li giúp tăng khả năng hòa tan và làm sạch.
- Muối ăn: NaCl là một chất điện li quan trọng trong chế độ ăn uống hàng ngày, cung cấp ion Na+ và Cl- cần thiết cho cơ thể.
4. Bài Tập Vận Dụng Về Chất Điện Li
Để củng cố kiến thức, hãy cùng làm một số bài tập vận dụng sau:
Bài 1: Cho các chất sau: HCl, NaOH, CH3COOH, H2O, NaCl, NH3. Chất nào là chất điện li mạnh?
Đáp án: HCl, NaOH, NaCl.
Bài 2: Viết phương trình điện li của các chất sau:
- HNO3
- Ba(OH)2
- CH3COOH
- NH3
Đáp án:
- HNO3 → H+ + NO3-
- Ba(OH)2 → Ba2+ + 2OH-
- CH3COOH ⇌ H+ + CH3COO-
- NH3 + H2O ⇌ NH4+ + OH-
Bài 3: Dung dịch chất nào sau đây dẫn điện tốt nhất?
A. Dung dịch đường
B. Dung dịch NaCl 0.1M
C. Dung dịch CH3COOH 0.1M
D. Nước cất
Đáp án: B. Dung dịch NaCl 0.1M (vì NaCl là chất điện li mạnh, phân li hoàn toàn thành ion).
Bài 4: Cho 100ml dung dịch CH3COOH 0.1M có độ điện li α = 1%. Tính nồng độ ion H+ trong dung dịch.
Giải:
CH3COOH ⇌ H+ + CH3COO-
Nồng độ ban đầu: 0.1M
Nồng độ điện li: 0.1 * 0.01 = 0.001M
Vậy [H+] = 0.001M
5. Các Yếu Tố Ảnh Hưởng Đến Sự Điện Li
Sự điện li của một chất phụ thuộc vào nhiều yếu tố, bao gồm:
5.1. Bản Chất Của Chất Tan
Mỗi chất có cấu trúc và liên kết hóa học khác nhau, do đó khả năng điện li cũng khác nhau. Các hợp chất ion thường dễ điện li hơn các hợp chất cộng hóa trị.
5.2. Bản Chất Của Dung Môi
Dung môi phân cực như nước có khả năng solvat hóa các ion, giúp chúng tách ra khỏi nhau và tồn tại trong dung dịch. Các dung môi không phân cực thường không có khả năng này.
5.3. Nhiệt Độ
Nhiệt độ tăng thường làm tăng động năng của các phân tử, giúp chúng dễ dàng vượt qua các lực hút tĩnh điện và phân li thành ion.
5.4. Nồng Độ
Ở nồng độ cao, các ion có xu hướng tái hợp lại với nhau, làm giảm độ điện li. Do đó, độ điện li thường giảm khi tăng nồng độ.
6. Những Lỗi Thường Gặp Khi Học Về Chất Điện Li
Khi học về chất điện li, học sinh thường mắc phải một số lỗi sau:
- Nhầm lẫn giữa chất tan và chất điện li: Không phải chất tan nào cũng là chất điện li. Ví dụ, đường tan trong nước nhưng không phân li thành ion.
- Không phân biệt được chất điện li mạnh và yếu: Cần nắm vững định nghĩa và ví dụ cụ thể của từng loại.
- Viết sai phương trình điện li: Cần chú ý đến điện tích của các ion và sử dụng mũi tên một chiều hoặc hai chiều cho phù hợp.
- Không hiểu rõ về độ điện li: Cần nắm vững công thức tính và các yếu tố ảnh hưởng đến độ điện li.
7. FAQ – Câu Hỏi Thường Gặp Về Chất Điện Li
Câu 1: Tại sao dung dịch muối ăn lại dẫn điện?
Dung dịch muối ăn (NaCl) dẫn điện vì NaCl là chất điện li mạnh, phân li hoàn toàn thành ion Na+ và Cl- trong nước. Các ion này di chuyển tự do và mang điện tích, giúp dung dịch dẫn điện.
Câu 2: Axit axetic (CH3COOH) là chất điện li mạnh hay yếu?
Axit axetic là chất điện li yếu. Khi tan trong nước, chỉ một phần nhỏ các phân tử CH3COOH phân li thành ion H+ và CH3COO-, phần lớn vẫn tồn tại dưới dạng phân tử CH3COOH.
Câu 3: Độ điện li là gì và nó có ý nghĩa gì?
Độ điện li (α) là đại lượng đặc trưng cho mức độ điện li của một chất điện li yếu trong dung dịch. Nó cho biết tỉ lệ giữa số mol chất đã điện li và tổng số mol chất hòa tan. Độ điện li càng lớn thì chất điện li càng mạnh.
Câu 4: Tại sao nhiệt độ lại ảnh hưởng đến sự điện li?
Nhiệt độ tăng làm tăng động năng của các phân tử, giúp chúng dễ dàng vượt qua các lực hút tĩnh điện và phân li thành ion. Do đó, nhiệt độ cao thường làm tăng độ điện li.
Câu 5: Các chất không điện li có dẫn điện không?
Các chất không điện li (ví dụ: đường, rượu) không phân li thành ion trong dung dịch, do đó dung dịch của chúng không dẫn điện.
Câu 6: Làm thế nào để phân biệt dung dịch chất điện li mạnh và yếu bằng thực nghiệm?
Có thể sử dụng một mạch điện đơn giản với nguồn điện, bóng đèn và hai điện cực nhúng vào dung dịch. Dung dịch chất điện li mạnh sẽ làm bóng đèn sáng hơn so với dung dịch chất điện li yếu.
Câu 7: Tại sao nước cất không dẫn điện?
Nước cất là nước tinh khiết, chứa rất ít ion. Do đó, nó dẫn điện rất kém. Tuy nhiên, nước tự nhiên (như nước máy, nước sông) chứa nhiều ion khoáng chất nên có khả năng dẫn điện tốt hơn.
Câu 8: Chất điện li có vai trò gì trong cơ thể người?
Chất điện li đóng vai trò quan trọng trong việc duy trì cân bằng nước và điện giải trong cơ thể, điều hòa hoạt động của hệ thần kinh và cơ bắp, và tham gia vào nhiều quá trình sinh hóa quan trọng.
Câu 9: Tại sao cần bổ sung chất điện li sau khi vận động mạnh?
Khi vận động mạnh, cơ thể mất nhiều mồ hôi, trong đó có các ion khoáng chất (chất điện li). Bổ sung chất điện li giúp bù đắp lượng ion đã mất, duy trì cân bằng điện giải và giúp cơ thể phục hồi nhanh hơn.
Câu 10: Muối ăn (NaCl) là chất điện li mạnh hay yếu?
Muối ăn (NaCl) là chất điện li mạnh. Khi hòa tan trong nước, NaCl phân li hoàn toàn thành ion Na+ và Cl-.
8. Tổng Kết
Hiểu rõ về chất điện li mạnh và yếu là kiến thức quan trọng trong hóa học. Hy vọng bài viết này của CAUHOI2025.EDU.VN đã giúp bạn nắm vững các khái niệm, tính chất và ứng dụng của chúng.
Bạn vẫn còn thắc mắc về chất điện li? Đừng ngần ngại truy cập CAUHOI2025.EDU.VN để tìm kiếm thêm thông tin và đặt câu hỏi. Chúng tôi luôn sẵn sàng giải đáp mọi thắc mắc của bạn một cách nhanh chóng và chính xác.
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Ảnh minh họa nước điện giải bù khoáng sau vận động
Tìm hiểu thêm về các chủ đề hóa học khác và nâng cao kiến thức của bạn cùng CauHoi2025.EDU.VN ngay hôm nay!