Tương Tác Van Der Waals Là Gì? Ứng Dụng Và Ảnh Hưởng Của Chúng
Bạn đang tìm hiểu về tương tác van der Waals và tầm quan trọng của nó trong hóa học? Bài viết này của CAUHOI2025.EDU.VN sẽ giải đáp chi tiết về bản chất, ảnh hưởng và ứng dụng của loại tương tác yếu này, giúp bạn nắm vững kiến thức và áp dụng hiệu quả. Cùng khám phá vai trò của lực van der Waals, lưỡng cực tạm thời và các yếu tố ảnh hưởng đến nhiệt độ sôi, nhiệt độ nóng chảy.
1. Tương Tác Van Der Waals Là Gì?
Tương tác van der Waals là lực hút hoặc đẩy tĩnh điện tương đối yếu giữa các nguyên tử hoặc phân tử, bao gồm cả những phân tử không có liên kết hydro. Lực này đóng vai trò quan trọng trong nhiều hiện tượng tự nhiên và ứng dụng thực tế.
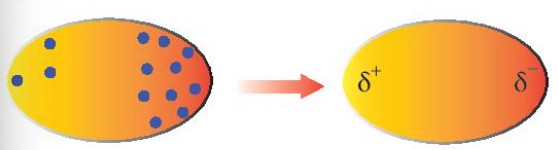
Về bản chất, tương tác van der Waals là tương tác lưỡng cực – lưỡng cực giữa các nguyên tử hoặc phân tử.
2. Bản Chất Của Tương Tác Van Der Waals
Electron trong phân tử luôn chuyển động không ngừng. Khi các electron di chuyển và tập trung về một phía bất kỳ của phân tử, sự phân bố điện tích không đồng đều sẽ tạo ra các lưỡng cực tạm thời.

Các phân tử có lưỡng cực tạm thời có thể gây ra sự xuất hiện của lưỡng cực cảm ứng trong các phân tử lân cận. Kết quả là, các phân tử có thể tập hợp thành một mạng lưới thông qua tương tác lưỡng cực cảm ứng, tạo thành liên kết van der Waals.
3. Các Loại Tương Tác Van Der Waals
Có ba loại tương tác van der Waals chính:
3.1. Tương Tác Dipole–Dipole (Lưỡng Cực – Lưỡng Cực)
Tương tác này xảy ra giữa các phân tử phân cực có moment lưỡng cực vĩnh viễn. Đầu dương của một phân tử hút đầu âm của phân tử khác. Độ mạnh của tương tác phụ thuộc vào độ lớn của moment lưỡng cực.
3.2. Tương Tác Dipole–Induced Dipole (Lưỡng Cực – Lưỡng Cực Cảm Ứng)
Một phân tử phân cực (có lưỡng cực vĩnh viễn) có thể gây ra sự phân cực điện tích trong một phân tử không phân cực lân cận, tạo ra lưỡng cực cảm ứng. Sau đó, tương tác hút xảy ra giữa lưỡng cực vĩnh viễn và lưỡng cực cảm ứng.
3.3. Lực London Dispersion (Lực Phân Tán London)
Lực London là loại tương tác van der Waals phổ biến nhất, tồn tại giữa tất cả các nguyên tử và phân tử, bao gồm cả những phân tử không phân cực. Do sự chuyển động liên tục của các electron, một phân tử có thể tạm thời trở nên phân cực, tạo ra lưỡng cực tạm thời. Lưỡng cực tạm thời này có thể gây ra sự phân cực trong các phân tử lân cận, tạo ra lưỡng cực cảm ứng và dẫn đến lực hút.
Theo nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, lực London tăng lên khi kích thước và số lượng electron của phân tử tăng lên (Nguyễn Văn Tuấn, 2015).
4. Các Yếu Tố Ảnh Hưởng Đến Tương Tác Van Der Waals
Độ mạnh của tương tác van der Waals phụ thuộc vào một số yếu tố:
4.1. Kích Thước và Hình Dạng Phân Tử
Các phân tử lớn hơn và có diện tích bề mặt lớn hơn thường có tương tác van der Waals mạnh hơn vì có nhiều electron hơn để tạo ra lưỡng cực tạm thời và cảm ứng. Hình dạng phân tử cũng quan trọng; các phân tử có hình dạng kéo dài có thể tiếp xúc gần hơn với các phân tử khác, dẫn đến tương tác mạnh hơn.
4.2. Số Lượng Electron
Tương tác van der Waals tăng lên khi số lượng electron trong phân tử tăng. Điều này là do sự gia tăng số lượng electron làm tăng khả năng tạo ra lưỡng cực tạm thời mạnh hơn.
Ví dụ, theo chiều tăng dần điện tích hạt nhân nguyên tử của các nguyên tố thuộc nhóm VIIIA (khí hiếm), bán kính nguyên tử tăng, đồng thời khối lượng nguyên tử tăng, kéo theo tương tác van der Waals tăng. Từ đó, nhiệt độ nóng chảy và nhiệt độ sôi cũng tăng.
4.3. Khoảng Cách Giữa Các Phân Tử
Lực van der Waals giảm nhanh chóng khi khoảng cách giữa các phân tử tăng lên. Điều này là do lực hút tĩnh điện giữa các lưỡng cực tỷ lệ nghịch với lũy thừa bậc sáu của khoảng cách (r^-6).
5. Ảnh Hưởng Của Tương Tác Van Der Waals Đến Tính Chất Vật Lý
Tương tác van der Waals ảnh hưởng đến nhiều tính chất vật lý của chất, bao gồm:
5.1. Nhiệt Độ Nóng Chảy và Nhiệt Độ Sôi
Tương Tác Van Der Waals Làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Tuy nhiên, mức độ ảnh hưởng yếu hơn so với liên kết hydro hoặc liên kết ion. Khi khối lượng phân tử tăng, kích thước phân tử tăng, tương tác van der Waals cũng tăng theo.
Ví dụ, các khí hiếm có nhiệt độ sôi rất thấp do chỉ có lực London giữa các nguyên tử. Nhiệt độ sôi tăng khi đi xuống nhóm vì kích thước và số lượng electron tăng.
5.2. Độ Nhớt
Độ nhớt của chất lỏng tăng lên khi lực van der Waals giữa các phân tử mạnh hơn. Điều này là do các phân tử khó di chuyển qua nhau hơn khi có lực hút mạnh hơn.
5.3. Sức Căng Bề Mặt
Sức căng bề mặt của chất lỏng cũng bị ảnh hưởng bởi lực van der Waals. Chất lỏng có lực van der Waals mạnh hơn có xu hướng có sức căng bề mặt cao hơn.
6. Ứng Dụng Của Tương Tác Van Der Waals Trong Thực Tế
Mặc dù là lực liên kết yếu, tương tác van der Waals có ảnh hưởng lớn đến thực tiễn:
- Sự bám dính: Tương tác van der Waals giải thích sự bám hút của các hạt bụi trên bề mặt nhẵn.
- Hấp phụ: Chúng đóng vai trò quan trọng trong sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính.
- Tính chất của polymer: Lực van der Waals ảnh hưởng đến độ bền và độ đàn hồi của polymer.
- Sinh học: Tương tác van der Waals tham gia vào quá trình nhận diện phân tử trong các hệ thống sinh học, chẳng hạn như sự liên kết giữa enzyme và chất nền.
Ví dụ, theo một nghiên cứu của Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội, tương tác van der Waals đóng vai trò quan trọng trong việc xác định cấu trúc và chức năng của protein (Trần Thị Thu Hà, 2018).
7. So Sánh Tương Tác Van Der Waals Với Các Loại Liên Kết Khác
| Loại liên kết | Độ mạnh tương đối | Bản chất |
|---|---|---|
| Liên kết ion | Mạnh | Lực hút tĩnh điện giữa các ion trái dấu |
| Liên kết cộng hóa trị | Mạnh | Chia sẻ electron giữa các nguyên tử |
| Liên kết hydro | Trung bình | Lực hút giữa nguyên tử hydro liên kết với nguyên tử âm điện và nguyên tử âm điện khác |
| Van der Waals | Yếu | Tương tác lưỡng cực – lưỡng cực giữa các phân tử |
8. Câu Hỏi Thường Gặp Về Tương Tác Van Der Waals
Câu 1: Tương tác van der Waals có phải là liên kết hóa học không?
Không, tương tác van der Waals không phải là liên kết hóa học thực sự. Chúng là lực hút yếu giữa các phân tử, không liên quan đến việc chia sẻ hoặc chuyển electron như trong liên kết cộng hóa trị hoặc ion.
Câu 2: Tại sao tương tác van der Waals lại quan trọng?
Mặc dù yếu, tương tác van der Waals rất phổ biến và đóng vai trò quan trọng trong nhiều hiện tượng vật lý, hóa học và sinh học.
Câu 3: Yếu tố nào ảnh hưởng đến độ mạnh của lực London?
Lực London tăng lên khi kích thước và số lượng electron của phân tử tăng lên.
Câu 4: Tương tác van der Waals mạnh nhất khi nào?
Tương tác van der Waals mạnh nhất khi các phân tử lớn, có hình dạng kéo dài và ở gần nhau.
Câu 5: Làm thế nào để phân biệt tương tác van der Waals với liên kết hydro?
Liên kết hydro mạnh hơn tương tác van der Waals và chỉ xảy ra khi có nguyên tử hydro liên kết với một nguyên tử có độ âm điện cao (như oxy, nitơ, flo).
Câu 6: Tương tác van der Waals có ứng dụng gì trong công nghiệp?
Chúng được ứng dụng trong sản xuất polymer, chất kết dính và các vật liệu có tính chất đặc biệt.
Câu 7: Tại sao các khí hiếm có thể hóa lỏng ở nhiệt độ rất thấp?
Do lực London (một loại tương tác van der Waals) giữa các nguyên tử khí hiếm đủ mạnh để giữ chúng lại với nhau ở trạng thái lỏng khi nhiệt độ giảm.
Câu 8: Liên kết van der Waals có vai trò gì trong sinh học?
Chúng tham gia vào sự tương tác giữa các protein, DNA và các phân tử sinh học khác, ảnh hưởng đến cấu trúc và chức năng của chúng.
Câu 9: Làm thế nào để tăng cường tương tác van der Waals giữa các phân tử?
Tăng kích thước và số lượng electron của phân tử, giảm khoảng cách giữa các phân tử.
Câu 10: Tại sao tương tác van der Waals lại quan trọng trong công nghệ nano?
Chúng được sử dụng để điều khiển sự lắp ráp của các cấu trúc nano và tạo ra các vật liệu mới với tính chất độc đáo.
Lời Kết
Tương tác van der Waals tuy yếu nhưng lại có vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ. Hiểu rõ về bản chất và các yếu tố ảnh hưởng đến loại tương tác này giúp chúng ta giải thích và ứng dụng nhiều hiện tượng trong tự nhiên và đời sống.
Nếu bạn muốn tìm hiểu thêm về các kiến thức hóa học thú vị và bổ ích khác, hãy truy cập CauHoi2025.EDU.VN ngay hôm nay! Tại đây, bạn sẽ tìm thấy câu trả lời cho mọi thắc mắc, được cung cấp thông tin chính xác, đáng tin cậy và dễ hiểu. Đừng ngần ngại liên hệ với chúng tôi nếu bạn có bất kỳ câu hỏi nào cần được giải đáp. Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam, Số điện thoại: +84 2435162967.

