Muối Carbonate Là Gì? Phân Loại, Tính Chất, Ứng Dụng & Bài Tập
Tìm hiểu tất tần tật về Muối Carbonate: định nghĩa, phân loại (carbonate trung hòa, hidrocacbonat), tính chất hóa học đặc trưng và ứng dụng thực tế trong đời sống và sản xuất. CAUHOI2025.EDU.VN sẽ giúp bạn nắm vững kiến thức này.
Muối carbonate là một hợp chất hóa học quan trọng, có mặt ở khắp mọi nơi trong cuộc sống. Bạn có muốn khám phá sâu hơn về loại muối này, từ định nghĩa cơ bản đến các ứng dụng thực tiễn của nó? CAUHOI2025.EDU.VN sẽ cung cấp cho bạn những thông tin chi tiết và dễ hiểu nhất về muối carbonate, giúp bạn tự tin áp dụng kiến thức vào học tập và cuộc sống hàng ngày. Hãy cùng tìm hiểu về muối carbonate, từ tính chất hóa học đặc trưng đến vai trò không thể thiếu trong nhiều ngành công nghiệp, cùng những thông tin hữu ích khác!
1. Muối Carbonate Là Gì?
Muối carbonate là muối của axit carbonic (H₂CO₃), bao gồm hai loại chính: muối carbonate (CO₃²⁻) và muối hidrocacbonat (HCO₃⁻). Muối carbonate rất phổ biến trong tự nhiên và có nhiều ứng dụng quan trọng, từ sản xuất vật liệu xây dựng đến các ứng dụng trong y học và đời sống hàng ngày.
Muối carbonate đóng vai trò quan trọng trong nhiều quá trình tự nhiên và công nghiệp. Ví dụ, canxi carbonate (CaCO₃) là thành phần chính của đá vôi và được sử dụng rộng rãi trong xây dựng. Natri carbonate (Na₂CO₃), hay còn gọi là soda ash, là một hóa chất quan trọng trong sản xuất thủy tinh, xà phòng và nhiều sản phẩm khác.
2. Phân Loại Muối Carbonate
Muối carbonate được chia thành hai loại chính dựa trên thành phần gốc axit của chúng:
2.1. Muối Carbonate Trung Hòa (Carbonate)
Muối carbonate trung hòa là các muối trong đó không còn nguyên tố hydro (H) trong thành phần gốc axit (CO₃²⁻).
Ví dụ:
- Magie carbonate (MgCO₃): Được sử dụng trong sản xuất vật liệu chịu lửa, cao su và mỹ phẩm.
- Canxi carbonate (CaCO₃): Thành phần chính của đá vôi, đá phấn và được sử dụng rộng rãi trong xây dựng, sản xuất giấy và dược phẩm. Theo Tổng cục Thống kê, ngành xây dựng Việt Nam sử dụng hàng triệu tấn CaCO₃ mỗi năm.
- Natri carbonate (Na₂CO₃): Sử dụng trong sản xuất thủy tinh, xà phòng, chất tẩy rửa và nhiều hóa chất khác.
2.2. Muối Hidrocacbonat (Bicarbonate)
Muối hidrocacbonat là các muối trong đó vẫn còn nguyên tố hydro (H) trong thành phần gốc axit (HCO₃⁻).
Ví dụ:
- Natri hidrocacbonat (NaHCO₃): Còn được gọi là baking soda, được sử dụng rộng rãi trong nấu ăn, làm bánh, sản xuất thuốc kháng axit và trong các ứng dụng làm sạch.
- Canxi hidrocacbonat (Ca(HCO₃)₂): Tồn tại trong nước tự nhiên và gây ra độ cứng tạm thời của nước.
- Kali hidrocacbonat (KHCO₃): Sử dụng trong sản xuất phân bón, thuốc chữa bệnh và trong công nghiệp thực phẩm.

3. Tính Chất Vật Lý của Muối Carbonate
Tính chất vật lý của muối carbonate có thể khác nhau tùy thuộc vào loại muối và điều kiện môi trường. Tuy nhiên, một số đặc điểm chung bao gồm:
- Trạng thái: Muối carbonate thường tồn tại ở trạng thái rắn ở nhiệt độ phòng.
- Màu sắc: Màu sắc của muối carbonate có thể thay đổi tùy thuộc vào thành phần hóa học và tạp chất. Ví dụ, canxi carbonate thường có màu trắng, trong khi các muối carbonate của kim loại chuyển tiếp có thể có màu khác nhau.
- Độ tan: Độ tan của muối carbonate trong nước thay đổi tùy thuộc vào loại muối. Hầu hết các muối carbonate của kim loại kiềm (như natri và kali) tan tốt trong nước, trong khi các muối carbonate của kim loại kiềm thổ (như canxi và magie) ít tan hơn.
Độ tan của muối hidrocacbonat thường cao hơn so với muối carbonate tương ứng. Ví dụ, canxi carbonate ít tan trong nước, nhưng canxi hidrocacbonat lại tan tốt hơn, điều này giải thích tại sao nó có thể tồn tại trong nước tự nhiên.
4. Tính Tan Của Muối Carbonate
Độ tan của muối carbonate trong nước là một yếu tố quan trọng ảnh hưởng đến ứng dụng và vai trò của chúng trong tự nhiên và công nghiệp.
- Muối carbonate: Đa số muối carbonate (CO₃²⁻) không tan trong nước, trừ các muối của kim loại kiềm như Na₂CO₃ và K₂CO₃. Điều này giải thích vì sao CaCO₃ kết tủa trong nhiều môi trường nước.
- Muối hidrocacbonat: Hầu hết muối hidrocacbonat (HCO₃⁻) đều tan trong nước, ví dụ như Mg(HCO₃)₂ và Ca(HCO₃)₂. Điều này quan trọng trong việc duy trì cân bằng pH trong các hệ thống sinh học và địa chất.
Theo một nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, độ tan của muối carbonate và hidrocacbonat ảnh hưởng lớn đến quá trình hình thành thạch nhũ trong các hang động đá vôi ở Việt Nam.
5. Tính Chất Hóa Học Của Muối Carbonate
Muối carbonate có nhiều tính chất hóa học quan trọng, bao gồm khả năng tác dụng với axit, bazơ, dung dịch muối khác và khả năng bị nhiệt phân hủy. Dưới đây là các phản ứng hóa học điển hình của muối carbonate:
5.1. Tác Dụng Với Axit
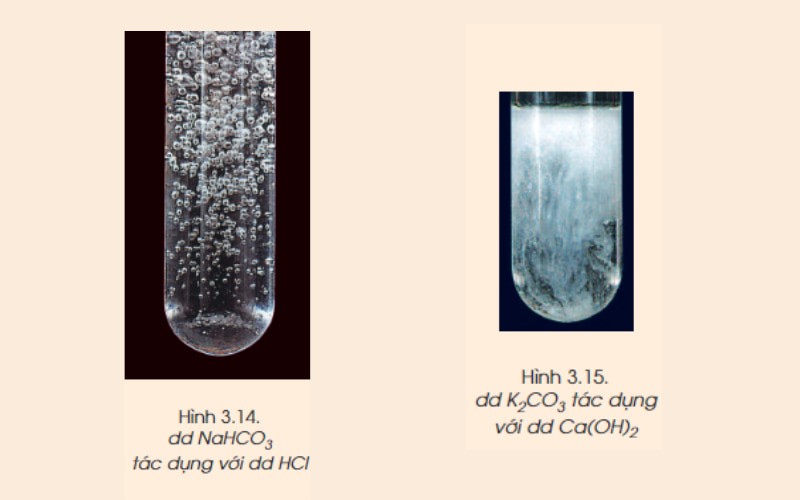
Muối carbonate tác dụng với axit mạnh hơn axit carbonic, tạo thành muối mới và giải phóng khí CO₂. Phản ứng này thường được sử dụng để nhận biết muối carbonate.
Ví dụ:
-
Phản ứng của natri hidrocacbonat (NaHCO₃) với axit clohidric (HCl):
NaHCO₃(dd) + HCl(dd) → NaCl(dd) + H₂O(l) + CO₂(k)
-
Phản ứng của natri carbonate (Na₂CO₃) với axit clohidric (HCl):
Na₂CO₃(dd) + 2HCl(dd) → 2NaCl(dd) + H₂O(l) + CO₂(k)
5.2. Tác Dụng Với Dung Dịch Bazơ
Một số dung dịch muối carbonate có thể phản ứng với dung dịch bazơ tạo thành muối carbonate không tan và bazơ mới.
Ví dụ:
-
Phản ứng của kali carbonate (K₂CO₃) với canxi hidroxit (Ca(OH)₂):
K₂CO₃(dd) + Ca(OH)₂(dd) → CaCO₃(rắn, trắng) + 2KOH(dd)
Lưu ý: Muối hidrocacbonat tác dụng với dung dịch kiềm sẽ tạo thành muối trung hòa và nước.
Ví dụ:
NaHCO₃(dd) + NaOH(dd) → Na₂CO₃(dd) + H₂O(l)
5.3. Tác Dụng Với Dung Dịch Muối
Dung dịch muối carbonate có thể tác dụng với một số dung dịch muối khác, tạo thành hai muối mới.
Ví dụ:
-
Phản ứng của natri carbonate (Na₂CO₃) với canxi clorua (CaCl₂):
Na₂CO₃(dd) + CaCl₂(dd) → CaCO₃(rắn, trắng) + 2NaCl(dd)
5.4. Phản Ứng Nhiệt Phân Hủy
Nhiều muối carbonate, trừ muối carbonate trung hòa của kim loại kiềm, dễ bị nhiệt phân hủy giải phóng khí cacbonic (CO₂).
Ví dụ:
-
Phân hủy canxi carbonate (CaCO₃):
CaCO₃(r) → (nhiệt độ) CaO(r) + CO₂(k)
-
Phân hủy natri hidrocacbonat (NaHCO₃):
2NaHCO₃(r) → (nhiệt độ) Na₂CO₃(r) + H₂O(h) + CO₂(k)

6. Ứng Dụng Của Muối Carbonate Trong Đời Sống Và Sản Xuất
Muối carbonate có rất nhiều ứng dụng quan trọng trong đời sống và sản xuất công nghiệp. Dưới đây là một số ứng dụng cụ thể của từng loại muối carbonate:
6.1. Canxi Carbonate (CaCO₃)
- Công nghiệp xây dựng: Sử dụng làm đá xây dựng, cẩm thạch và là thành phần cấu thành của xi măng. Theo Hiệp hội Xi măng Việt Nam, canxi carbonate là một thành phần không thể thiếu trong sản xuất xi măng.
- Ngành sơn: Sử dụng làm chất độn chính trong sơn.
- Sản xuất nhựa và cao su: Sử dụng làm chất độn trong tấm trần, khung nhựa, ống PVC.
6.2. Natri Carbonate (Na₂CO₃)
- Sản xuất thủy tinh: Là nguyên liệu chính, chiếm 13-15% thành phần.
- Sản xuất xà phòng và chất tẩy rửa: Sử dụng làm chất phụ gia.
- Nguyên liệu cho nhiều sản phẩm hóa chất gốc natri: Ví dụ như sản xuất natri silicat, natri photphat.
6.3. Natri Hidrocacbonat (NaHCO₃)
- Thực phẩm: Tạo độ giòn, xốp và làm đẹp cho bánh (baking soda).
- Dược phẩm: Tạo bọt và tăng pH trong một số loại thuốc như thuốc nhức đầu, thuốc kháng axit.
- Chăm sóc răng miệng: Phòng ngừa sâu răng, mòn răng, bệnh nha chu.
- Y tế: Chế phẩm trung hòa acid dịch vị chữa bệnh trào ngược dạ dày.
7. Các Loại Muối Carbonate Phổ Biến và Ứng Dụng Cụ Thể
| Tên muối | Công thức hóa học | Ứng dụng |
|---|---|---|
| Canxi carbonate | CaCO₃ | – Sản xuất xi măng, vôi, vật liệu xây dựng. – Chất độn trong sản xuất giấy, nhựa, sơn, cao su. – Thành phần trong một số loại thuốc kháng axit. |
| Natri carbonate | Na₂CO₃ | – Sản xuất thủy tinh. – Sản xuất xà phòng, chất tẩy rửa. – Điều chỉnh độ pH trong xử lý nước. |
| Natri hidrocacbonat | NaHCO₃ | – Bột nở trong làm bánh. – Thuốc kháng axit, giảm đau dạ dày. – Chất khử mùi. – Thành phần trong bình chữa cháy. |
| Kali carbonate | K₂CO₃ | – Sản xuất thủy tinh đặc biệt. – Sản xuất xà phòng lỏng. – Thành phần trong phân bón. |
| Magie carbonate | MgCO₃ | – Sản xuất vật liệu chịu lửa. – Chất độn trong cao su. – Thành phần trong một số loại thuốc nhuận tràng và thuốc kháng axit. |
| Amoni carbonate | (NH₄)₂CO₃ | – Bột nở trong sản xuất bánh quy và bánh ngọt. – Thành phần trong một số loại thuốc ho long đờm. – Sử dụng trong công nghiệp dệt nhuộm. |
8. Nhận Biết Muối Carbonate
Có một số phương pháp đơn giản để nhận biết muối carbonate trong phòng thí nghiệm hoặc trong điều kiện thực tế. Dưới đây là một số cách phổ biến:
-
Phản ứng với axit:
-
Cách thực hiện: Nhỏ vài giọt axit clohidric (HCl) loãng hoặc axit sulfuric (H₂SO₄) loãng vào mẫu chất cần kiểm tra.
-
Dấu hiệu nhận biết: Nếu mẫu chất là muối carbonate, sẽ có khí CO₂ thoát ra, tạo thành bọt khí. Khí CO₂ này có thể làm đục nước vôi trong nếu dẫn qua.
-
Phương trình hóa học tổng quát:
M₂CO₃ + 2HCl → 2MCl + H₂O + CO₂↑ MHCO₃ + HCl → MCl + H₂O + CO₂↑(Trong đó, M là kim loại kiềm hoặc kim loại kiềm thổ)
-
-
Phản ứng với dung dịch bazơ (đối với muối hidrocacbonat):
-
Cách thực hiện: Cho dung dịch muối hidrocacbonat tác dụng với dung dịch bazơ mạnh như NaOH hoặc Ca(OH)₂.
-
Dấu hiệu nhận biết: Nếu là muối hidrocacbonat, sẽ tạo thành muối carbonate kết tủa (nếu muối carbonate đó không tan).
-
Ví dụ:
Ca(HCO₃)₂ + Ca(OH)₂ → 2CaCO₃↓ + 2H₂O
-
-
Phản ứng nhiệt phân hủy:
-
Cách thực hiện: Nung nóng mẫu chất cần kiểm tra.
-
Dấu hiệu nhận biết: Nếu mẫu chất là muối carbonate (trừ muối carbonate của kim loại kiềm), sẽ bị phân hủy tạo thành oxit kim loại và khí CO₂.
-
Ví dụ:
CaCO₃ → CaO + CO₂↑(Nhiệt độ cao)
Khí CO₂ thoát ra có thể được nhận biết bằng cách dẫn qua nước vôi trong, làm nước vôi trong bị đục.
-
-
Sử dụng thuốc thử đặc trưng:
- Một số thuốc thử có thể tạo màu đặc trưng với muối carbonate, giúp nhận biết chúng một cách dễ dàng. Tuy nhiên, phương pháp này thường phức tạp và ít được sử dụng trong các thí nghiệm đơn giản.
Lưu ý:
- Khi thực hiện các thí nghiệm nhận biết, cần đảm bảo an toàn, đặc biệt khi sử dụng axit và bazơ mạnh.
- Kết quả nhận biết cần được xem xét trong mối liên hệ với các tính chất khác của mẫu chất để đưa ra kết luận chính xác.
9. Bài Tập Về Muối Carbonate (SGK Hóa Học 9) Kèm Lời Giải
Dưới đây là một số bài tập về muối carbonate để các bạn ôn tập lại kiến thức lý thuyết và áp dụng thực hành:
9.1. Bài Tập 2 SGK Hóa Học 9, Trang 91
Dựa vào tính chất hóa học của muối cacbonat, hãy nêu tính chất của muối MgCO₃ và viết các phương trình hóa học minh họa.
Gợi ý đáp án:
MgCO₃ có tính chất của muối cacbonat.
-
Tác dụng với dung dịch axit:
MgCO₃ + H₂SO₄ → MgSO₄ + CO₂ ↑ + H₂O
-
MgCO₃ không tan trong nước, không tác dụng với dung dịch muối và dung dịch bazơ.
-
Dễ bị phân hủy:
MgCO₃ → (nhiệt độ) MgO + CO₂
9.2. Bài Tập 3 SGK Hóa Học 9, Trang 91
Viết các phương trình hóa học biểu diễn chuyển hóa sau:
C → CO₂ → CaCO₃ → CO₂
Gợi ý đáp án:
Các phương trình hóa học:
(1) C + O₂ → (nhiệt độ) CO₂
(2) CO₂ + Ca(OH)₂ → CaCO₃ ↓ + H₂O
(3) CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O
9.3. Bài Tập 4 SGK Hóa Học 9, Trang 91
Hãy cho biết trong các cặp chất sau đây, cặp nào có thể tác dụng với nhau.
a) H₂SO₄ và KHCO₃; b) K₂CO₃ và NaCl; c) MgCO₃ và HCl; d) CaCl₂ và Na₂CO₃; e) Ba(OH)₂ và K₂CO₃
Giải thích và viết các phương trình hóa học.
Gợi ý đáp án:
Những cặp chất tác dụng với nhau là cặp chất a, c, d và e. Phương trình hóa học như sau:
H₂SO₄ + 2KHCO₃ → K₂SO₄ + 2CO₂ ↑ + 2H₂O
MgCO₃ + 2HCl → MgCl₂ + CO₂ ↑ + H₂O
CaCl₂ + Na₂CO₃ → CaCO₃ ↓ + 2NaCl
Ba(OH)₂ + K₂CO₃ → BaCO₃ ↓ + 2KOH
Cặp chất không tác dụng với nhau: b).
Lưu ý: Điều kiện của phản ứng trao đổi trong dung dịch chỉ xảy ra nếu sản phẩm có chất kết tủa (không tan) hoặc có chất khí tạo thành.
9.4. Bài Tập 5 SGK Hóa Học 9, Trang 91
Hãy tính thể tích khí CO₂ (đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980g H₂SO₄ tác dụng hết với dung dịch NaHCO₃.
Gợi ý đáp án:
Phương trình hóa học của phản ứng:
2NaHCO₃ + H₂SO₄ → Na₂SO₄ + 2CO₂ ↑ + 2H₂O
Như vậy: nCO₂ = 2 x nH₂SO₄ = 10 x 2 = 20 mol.
VCO₂ = n x 22,4 = 20 x 22,4 = 448 lít.
10. Cân Bằng Carbonate Trong Tự Nhiên
Cân bằng carbonate là một hệ thống phức tạp liên quan đến sự chuyển đổi giữa các dạng khác nhau của carbon trong môi trường tự nhiên, bao gồm khí CO₂, axit carbonic (H₂CO₃), ion hidrocacbonat (HCO₃⁻) và ion carbonate (CO₃²⁻). Quá trình này đóng vai trò quan trọng trong việc điều chỉnh độ pH của nước, ảnh hưởng đến sự hòa tan của các khoáng chất và sự sống của các sinh vật thủy sinh.
10.1. Các Yếu Tố Ảnh Hưởng Đến Cân Bằng Carbonate
- Nồng độ CO₂ trong khí quyển: Nồng độ CO₂ trong khí quyển ảnh hưởng trực tiếp đến nồng độ CO₂ hòa tan trong nước. Khi nồng độ CO₂ tăng, lượng CO₂ hòa tan trong nước cũng tăng, làm giảm độ pH của nước.
- Nhiệt độ: Nhiệt độ ảnh hưởng đến khả năng hòa tan của CO₂ trong nước. Nhiệt độ càng cao, khả năng hòa tan CO₂ càng giảm.
- Độ pH: Độ pH của nước ảnh hưởng đến sự phân bố của các dạng carbon khác nhau. Ở pH thấp, dạng H₂CO₃ chiếm ưu thế. Ở pH trung bình, dạng HCO₃⁻ chiếm ưu thế. Ở pH cao, dạng CO₃²⁻ chiếm ưu thế.
- Áp suất: Áp suất ảnh hưởng đến khả năng hòa tan của CO₂ trong nước. Áp suất càng cao, khả năng hòa tan CO₂ càng tăng.
- Hoạt động sinh học: Các sinh vật quang hợp (như tảo và thực vật) sử dụng CO₂ để tạo ra chất hữu cơ, làm giảm nồng độ CO₂ trong nước. Các sinh vật hô hấp thải CO₂ vào nước, làm tăng nồng độ CO₂.
10.2. Vai Trò Của Cân Bằng Carbonate
- Điều chỉnh độ pH: Hệ thống carbonate hoạt động như một hệ đệm, giúp duy trì độ pH ổn định trong nước. Điều này rất quan trọng đối với sự sống của các sinh vật thủy sinh, vì độ pH quá cao hoặc quá thấp có thể gây hại cho chúng.
- Ảnh hưởng đến sự hòa tan của khoáng chất: Cân bằng carbonate ảnh hưởng đến sự hòa tan của các khoáng chất, đặc biệt là canxi carbonate (CaCO₃). CaCO₃ là thành phần chính của đá vôi và vỏ của nhiều loài sinh vật biển.
- Cung cấp CO₂ cho quang hợp: Các sinh vật quang hợp sử dụng CO₂ hòa tan trong nước để thực hiện quá trình quang hợp. Hệ thống carbonate giúp duy trì nồng độ CO₂ hòa tan ổn định, đảm bảo quá trình quang hợp diễn ra hiệu quả.
- Lưu trữ carbon: Các đại dương là một bể chứa carbon lớn, và hệ thống carbonate đóng vai trò quan trọng trong việc lưu trữ carbon trong nước biển.
10.3. Ảnh Hưởng Của Biến Đổi Khí Hậu
Biến đổi khí hậu đang gây ra những thay đổi lớn trong hệ thống carbonate, đặc biệt là do sự gia tăng nồng độ CO₂ trong khí quyển. Điều này dẫn đến hiện tượng axit hóa đại dương, làm giảm độ pH của nước biển và ảnh hưởng đến đời sống của các sinh vật biển, đặc biệt là các loài có vỏ bằng CaCO₃ (như san hô, trai, ốc).
Theo các nghiên cứu của Viện Hải dương học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, axit hóa đại dương đang là một thách thức lớn đối với các hệ sinh thái biển ở Việt Nam, đe dọa đến đa dạng sinh học và nguồn lợi thủy sản.
11. Các Câu Hỏi Thường Gặp (FAQ) Về Muối Carbonate
1. Muối carbonate có độc hại không?
- Đa số muối carbonate không độc hại ở nồng độ thấp. Tuy nhiên, một số muối carbonate có thể gây kích ứng da và mắt nếu tiếp xúc trực tiếp.
2. Muối carbonate có ăn được không?
- Một số muối carbonate như natri hidrocacbonat (baking soda) được sử dụng trong thực phẩm. Tuy nhiên, không nên ăn quá nhiều vì có thể gây rối loạn tiêu hóa.
3. Làm thế nào để bảo quản muối carbonate?
- Nên bảo quản muối carbonate ở nơi khô ráo, thoáng mát và tránh ánh nắng trực tiếp.
4. Muối carbonate có tác dụng gì trong nông nghiệp?
- Một số muối carbonate như canxi carbonate được sử dụng để cải tạo đất chua, cung cấp canxi cho cây trồng.
5. Muối carbonate có gây ô nhiễm môi trường không?
- Việc khai thác và sản xuất muối carbonate có thể gây ô nhiễm môi trường nếu không được quản lý đúng cách.
6. Muối carbonate có thể dùng để làm sạch không?
- Natri hidrocacbonat (baking soda) là một chất tẩy rửa tự nhiên, an toàn và hiệu quả.
7. Muối carbonate có thể dùng để chữa bệnh không?
- Một số muối carbonate như natri hidrocacbonat được sử dụng trong thuốc kháng axit để giảm triệu chứng ợ nóng, khó tiêu.
8. Sự khác biệt giữa muối carbonate và muối hidrocacbonat là gì?
- Muối carbonate có công thức chung là M₂CO₃, trong khi muối hidrocacbonat có công thức chung là MHCO₃ (M là kim loại). Muối hidrocacbonat có thêm một nguyên tử hydro trong thành phần.
9. Làm thế nào để phân biệt muối carbonate và muối clorua?
- Nhỏ axit vào muối carbonate sẽ tạo ra khí CO₂. Muối clorua không có phản ứng này.
10. Muối carbonate có vai trò gì trong cơ thể người?
- Muối carbonate giúp duy trì độ pH ổn định trong máu và các dịch cơ thể khác.
Bạn đang gặp khó khăn trong việc tìm kiếm thông tin chính xác và đáng tin cậy về muối carbonate? CAUHOI2025.EDU.VN cung cấp câu trả lời rõ ràng, súc tích và được nghiên cứu kỹ lưỡng cho các câu hỏi của bạn. Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay để khám phá thêm nhiều kiến thức hữu ích và tìm thấy giải pháp cho các vấn đề của bạn! Nếu bạn cần tư vấn sâu hơn, đừng ngần ngại liên hệ với chúng tôi theo địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc truy cập trang web CauHoi2025.EDU.VN để được hỗ trợ.

