![Phản Ứng Oxi Hóa Khử Là Gì? Ví Dụ Chi Tiết Nhất [2024] Phản Ứng Oxi Hóa Khử Là Gì? Ví Dụ Chi Tiết Nhất [2024]](https://cauhoi2025.edu.vn/wp-content/uploads/2025/06/phan-ung-oxi-hoa-khu-2.jpg)
Phản Ứng Oxi Hóa Khử Là Gì? Ví Dụ Chi Tiết Nhất [2024]
Bạn đang thắc mắc phản ứng oxi hóa khử là gì? Bạn muốn tìm hiểu các Ví Dụ Phản ứng Oxi Hóa Khử lớp 10 một cách dễ hiểu nhất? CAUHOI2025.EDU.VN sẽ giúp bạn nắm vững kiến thức về phản ứng oxi hóa khử, từ định nghĩa cơ bản đến các ví dụ minh họa chi tiết, giúp bạn tự tin giải quyết các bài tập hóa học.
1. Định Nghĩa Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất phản ứng. Điều này dẫn đến sự thay đổi số oxi hóa của một hoặc nhiều nguyên tố. Theo định nghĩa của Bộ Giáo dục và Đào tạo, phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Các thành phần chính trong phản ứng oxi hóa khử:
- Chất khử: Chất nhường electron, làm tăng số oxi hóa của mình. Quá trình chất khử nhường electron gọi là quá trình oxi hóa.
- Chất oxi hóa: Chất nhận electron, làm giảm số oxi hóa của mình. Quá trình chất oxi hóa nhận electron gọi là quá trình khử.
Ví dụ phản ứng oxi hóa khử:
Fe + CuSO₄ → Cu + FeSO₄
Trong phản ứng này:
- Sắt (Fe) là chất khử, vì số oxi hóa tăng từ 0 lên +2 (Fe⁰ → Fe²⁺ + 2e).
- Đồng (Cu) trong CuSO₄ là chất oxi hóa, vì số oxi hóa giảm từ +2 xuống 0 (Cu²⁺ + 2e → Cu⁰).
Kết luận: Phản ứng oxi hóa khử là phản ứng, trong đó xảy ra đồng thời quá trình oxi hóa và quá trình khử.
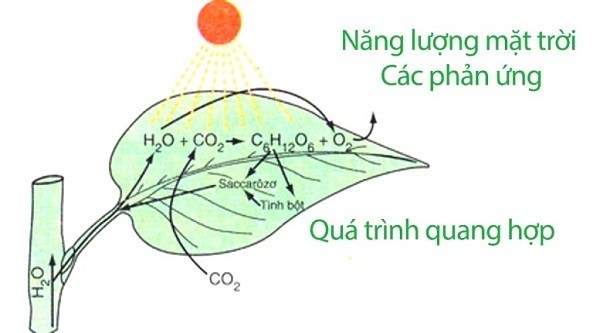
Quá trình quang hợp của cây xanh cũng là một phản ứng oxi hóa khử.
2. Dấu Hiệu Nhận Biết Phản Ứng Oxi Hóa Khử
Để nhận biết một phản ứng có phải là phản ứng oxi hóa khử hay không, bạn cần chú ý đến sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng. Nếu có sự thay đổi số oxi hóa, đó là phản ứng oxi hóa khử.
Ví dụ:
- Phản ứng đốt cháy: Đốt cháy nhiên liệu (như gas, than, củi) là phản ứng oxi hóa khử, vì có sự kết hợp của chất cháy với oxi, làm thay đổi số oxi hóa của các nguyên tố.
- Quá trình hô hấp: Quá trình hô hấp của con người và động vật là phản ứng oxi hóa khử, vì có sự oxi hóa các chất hữu cơ để tạo năng lượng.
- Quá trình quang hợp: Quá trình quang hợp của cây xanh là phản ứng oxi hóa khử, vì có sự khử CO₂ thành các chất hữu cơ và oxi hóa H₂O thành O₂.
- Sản xuất công nghiệp: Nhiều quy trình sản xuất công nghiệp như luyện kim, sản xuất phân bón, hóa chất, dược phẩm đều dựa trên các phản ứng oxi hóa khử.
3. Các Bước Viết Phương Trình Phản Ứng Oxi Hóa Khử
Để viết và cân bằng phương trình phản ứng oxi hóa khử một cách chính xác, bạn có thể thực hiện theo các bước sau:
Bước 1: Xác định số oxi hóa
Xác định số oxi hóa của tất cả các nguyên tố trong phản ứng để tìm ra các nguyên tố có sự thay đổi số oxi hóa.
Bước 2: Viết quá trình oxi hóa và quá trình khử
- Viết riêng quá trình oxi hóa (chất khử nhường electron).
- Viết riêng quá trình khử (chất oxi hóa nhận electron).
- Cân bằng số electron nhường và nhận trong hai quá trình.
Bước 3: Cộng hai quá trình và cân bằng phương trình
- Cộng hai quá trình oxi hóa và khử lại với nhau, đảm bảo số electron đã được cân bằng.
- Cân bằng phương trình phản ứng bằng cách thêm hệ số thích hợp.
Ví dụ: Cân bằng phản ứng: KMnO₄ + HCl → KCl + MnCl₂ + Cl₂ + H₂O
-
Xác định số oxi hóa:
- KMnO₄: K(+1), Mn(+7), O(-2)
- HCl: H(+1), Cl(-1)
- KCl: K(+1), Cl(-1)
- MnCl₂: Mn(+2), Cl(-1)
- Cl₂: Cl(0)
- H₂O: H(+1), O(-2)
-
Viết quá trình oxi hóa và khử:
- Quá trình khử: Mn^(+7) + 5e → Mn^(+2)
- Quá trình oxi hóa: 2Cl^(-1) → Cl₂ + 2e
-
Cân bằng số electron và cộng hai quá trình:
- Nhân quá trình khử với 2 và quá trình oxi hóa với 5 để cân bằng số electron:
- 2(Mn^(+7) + 5e → Mn^(+2))
- 5(2Cl^(-1) → Cl₂ + 2e)
- Cộng hai quá trình: 2Mn^(+7) + 10Cl^(-1) → 2Mn^(+2) + 5Cl₂
- Nhân quá trình khử với 2 và quá trình oxi hóa với 5 để cân bằng số electron:
-
Cân bằng phương trình:
- 2KMnO₄ + 10HCl → 2KCl + 2MnCl₂ + 5Cl₂ + 8H₂O (chưa cân bằng H và O)
- 2KMnO₄ + 16HCl → 2KCl + 2MnCl₂ + 5Cl₂ + 8H₂O (phương trình đã cân bằng)
4. Các Loại Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử có thể được phân loại dựa trên đặc điểm của chất oxi hóa và chất khử:
-
Phản ứng oxi hóa khử thông thường: Chất oxi hóa và chất khử là các phân tử khác nhau.
- Ví dụ: C + 4HNO₃ (đặc) → CO₂ + 4NO₂ + 2H₂O
- Ví dụ: Cu + 2H₂SO₄ (đặc) → CuSO₄ + SO₂ + 2H₂O
-
Phản ứng oxi hóa khử nội phân tử: Chất oxi hóa và chất khử thuộc cùng một phân tử, nhưng ở hai nguyên tử khác nhau.
- Ví dụ: NH₄NO₂ → N₂ + 2H₂O (Nitơ trong NH₄⁺ có số oxi hóa -3 bị oxi hóa, nitơ trong NO₂⁻ có số oxi hóa +3 bị khử)
- Ví dụ: 2KClO₃ → 2KCl + 3O₂ (Clo trong KClO₃ vừa bị oxi hóa, vừa bị khử)
-
Phản ứng tự oxi hóa khử (tự phản ứng): Chất khử đồng thời là chất oxi hóa.
- Ví dụ: Cl₂ + 2KOH → KCl + KClO + H₂O
- Ví dụ: 3KClO → 2KCl + KClO₃
- Ví dụ: 4KClO₃ → 3KClO₄ + KCl
5. Ví Dụ Phản Ứng Oxi Hóa Khử Lớp 10
Dưới đây là một số ví dụ cụ thể về phản ứng oxi hóa khử thường gặp trong chương trình Hóa học lớp 10:
5.1. Phản Ứng Giữa Al và HNO₃
Xét phản ứng giữa nhôm (Al) và axit nitric (HNO₃):
Al + HNO₃ → Al(NO₃)₃ + NO + H₂O
Để cân bằng phản ứng này, ta thực hiện các bước sau:
-
Xác định số oxi hóa:
- Al: 0 → +3
- N: +5 → +2
-
Viết quá trình oxi hóa và khử:
- Oxi hóa: Al → Al³⁺ + 3e
- Khử: N^(+5) + 3e → N^(+2)
-
Cân bằng electron và phương trình:
- Al → Al³⁺ + 3e
- N^(+5) + 3e → N^(+2)
- Al + 4HNO₃ → Al(NO₃)₃ + NO + 2H₂O (phương trình đã cân bằng)
5.2. Phản Ứng Giữa KMnO₄ và HCl
Xét phản ứng giữa kali pemanganat (KMnO₄) và axit clohidric (HCl):
KMnO₄ + HCl → KCl + MnCl₂ + Cl₂ + H₂O
Để cân bằng phản ứng này, ta thực hiện các bước sau:
-
Xác định số oxi hóa:
- Mn: +7 → +2
- Cl: -1 → 0
-
Viết quá trình oxi hóa và khử:
- Khử: Mn^(+7) + 5e → Mn^(+2)
- Oxi hóa: 2Cl⁻ → Cl₂ + 2e
-
Cân bằng electron và phương trình:
- 2KMnO₄ + 16HCl → 2KCl + 2MnCl₂ + 5Cl₂ + 8H₂O (phương trình đã cân bằng)

5.3. Phản Ứng Giữa Cu và H₂SO₄
Xét phản ứng giữa đồng (Cu) và axit sunfuric đặc (H₂SO₄):
Cu + H₂SO₄ → CuSO₄ + SO₂ + H₂O
Để cân bằng phản ứng này, ta thực hiện các bước sau:
-
Xác định số oxi hóa:
- Cu: 0 → +2
- S: +6 → +4
-
Viết quá trình oxi hóa và khử:
- Oxi hóa: Cu → Cu²⁺ + 2e
- Khử: S^(+6) + 2e → S^(+4)
-
Cân bằng electron và phương trình:
- Cu + 2H₂SO₄ → CuSO₄ + SO₂ + 2H₂O (phương trình đã cân bằng)

6. Bài Tập Về Phản Ứng Oxi Hóa Khử Lớp 10
Để củng cố kiến thức về phản ứng oxi hóa khử, bạn có thể tham khảo một số bài tập sau:
Bài tập 1: Xác định phản ứng nào sau đây là phản ứng oxi hóa khử:
A. CaCO₃ → CaO + CO₂
B. 2Al(OH)₃ → Al₂O₃ + 3H₂O
C. 2HgO → 2Hg + O₂
D. HNO₃ + NaOH → NaNO₃ + H₂O
Lời giải:
- Đáp án đúng là C. Trong phản ứng này, số oxi hóa của Hg và O thay đổi.
Bài tập 2: Trong phản ứng nào sau đây, NH₃ đóng vai trò là chất khử?
A. 4NH₃ + 5O₂ → 4NO + 6H₂O
B. 2NH₃ + 3Cl₂ → N₂ + 6HCl
C. 2NH₃ + 3CuO → 3Cu + N₂ + 3H₂O
D. 2NH₃ + H₂O₂ + MnSO₄ → MnO₂ + (NH₄)₂SO₄
Lời giải:
- Đáp án đúng là A, B và C. Trong các phản ứng này, N trong NH₃ tăng số oxi hóa từ -3 lên 0 hoặc +2.
Bài tập 3: Cho phản ứng: FeSO₄ + KMnO₄ + H₂SO₄ → Fe₂(SO₄)₃ + K₂SO₄ + MnSO₄ + H₂O. Xác định chất oxi hóa và chất khử trong phản ứng.
Lời giải:
- Chất oxi hóa: KMnO₄ (Mn^(+7) → Mn^(+2))
- Chất khử: FeSO₄ (Fe^(+2) → Fe^(+3))
Bài tập 4: Cần bao nhiêu gam đồng (Cu) để khử hoàn toàn lượng ion bạc có trong 85 ml dung dịch AgNO₃ 0,15M?
Lời giải:
- Tính số mol AgNO₃: n(AgNO₃) = 0.15M * 0.085L = 0.01275 mol
- Phương trình phản ứng: Cu + 2AgNO₃ → Cu(NO₃)₂ + 2Ag
- Theo phương trình, n(Cu) = 1/2 * n(AgNO₃) = 0.01275 mol / 2 = 0.006375 mol
- Tính khối lượng Cu: m(Cu) = 0.006375 mol * 63.55 g/mol = 0.405 g
Bài tập 5: Cân bằng phương trình hóa học sau bằng phương pháp thăng bằng electron: K₂Cr₂O₇ + HCl → KCl + CrCl₃ + H₂O + Cl₂
Lời giải:
-
Xác định số oxi hóa của các nguyên tố thay đổi:
- Cr: +6 → +3
- Cl: -1 → 0
-
Viết quá trình oxi hóa và khử:
- Khử: Cr₂^(+6) + 6e → 2Cr^(+3)
- Oxi hóa: 2Cl^(-1) → Cl₂ + 2e
-
Cân bằng số electron và cộng hai quá trình:
- Nhân quá trình oxi hóa với 3 để cân bằng số electron: 3(2Cl^(-1) → Cl₂ + 2e)
- K₂Cr₂O₇ + 14HCl → 2KCl + 2CrCl₃ + 7H₂O + 3Cl₂
7. Ứng Dụng Thực Tế Của Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử có vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp:
- Sản xuất điện: Pin và ắc quy hoạt động dựa trên các phản ứng oxi hóa khử để tạo ra dòng điện.
- Luyện kim: Các quá trình luyện kim sử dụng phản ứng oxi hóa khử để tách kim loại từ quặng.
- Xử lý nước: Phản ứng oxi hóa khử được sử dụng để khử trùng và loại bỏ các chất ô nhiễm trong nước.
- Y học: Các chất oxi hóa và khử được sử dụng trong nhiều loại thuốc và phương pháp điều trị bệnh.
- Nông nghiệp: Phân bón hóa học và thuốc trừ sâu thường chứa các chất oxi hóa hoặc khử để cung cấp dinh dưỡng cho cây trồng hoặc tiêu diệt sâu bệnh.
8. Tìm Hiểu Thêm Tại CAUHOI2025.EDU.VN
Hy vọng với những chia sẻ trên, bạn đã hiểu rõ hơn về phản ứng oxi hóa khử và có thể vận dụng vào giải các bài tập một cách hiệu quả. Nếu bạn có bất kỳ thắc mắc nào hoặc muốn tìm hiểu thêm về các chủ đề hóa học khác, hãy truy cập website CAUHOI2025.EDU.VN để được giải đáp và hỗ trợ.
Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Các bài viết chi tiết, dễ hiểu về các khái niệm hóa học.
- Các ví dụ minh họa cụ thể, giúp bạn nắm vững kiến thức.
- Các bài tập trắc nghiệm và tự luận, giúp bạn rèn luyện kỹ năng giải bài.
- Diễn đàn trao đổi, nơi bạn có thể đặt câu hỏi và thảo luận với các bạn học khác và các chuyên gia.
CAUHOI2025.EDU.VN luôn sẵn sàng đồng hành cùng bạn trên con đường chinh phục môn Hóa học!
Nếu bạn đang gặp khó khăn trong việc học Hóa hoặc muốn có một nguồn tài liệu tin cậy để tham khảo, đừng ngần ngại truy cập CAUHOI2025.EDU.VN. Chúng tôi cam kết cung cấp cho bạn những thông tin chính xác, đầy đủ và dễ hiểu nhất.
Lời kêu gọi hành động (CTA):
- Truy cập ngay CAUHOI2025.EDU.VN để khám phá thêm nhiều kiến thức hóa học thú vị và bổ ích!
- Đặt câu hỏi của bạn tại diễn đàn để được các chuyên gia và bạn học khác giải đáp!
- Liên hệ với chúng tôi qua địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc số điện thoại +84 2435162967 nếu bạn có bất kỳ yêu cầu hỗ trợ nào!
Chúng tôi tin rằng với sự đồng hành của CauHoi2025.EDU.VN, bạn sẽ tự tin chinh phục mọi thử thách trong môn Hóa học!