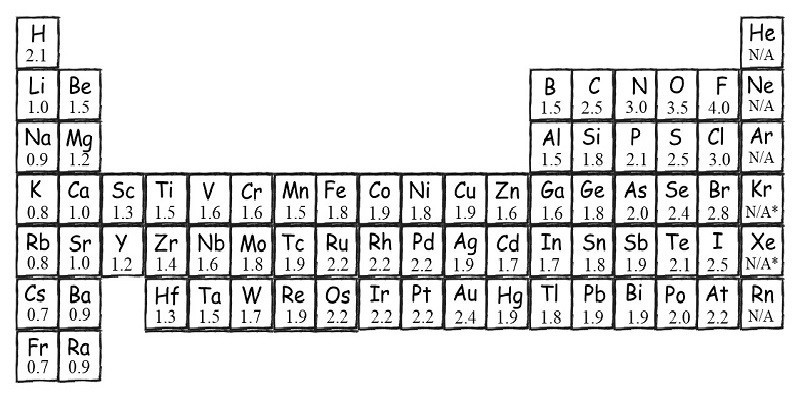
Độ Âm Điện Của Các Nguyên Tố Là Gì? Bảng Giá Trị Chi Tiết Nhất
Bạn muốn hiểu rõ về độ âm điện Của Các Nguyên Tố và vai trò của nó trong hóa học? CAUHOI2025.EDU.VN sẽ cung cấp bảng độ âm điện chi tiết, giải thích ý nghĩa, xu hướng và các yếu tố ảnh hưởng đến nó. Khám phá ngay để nắm vững kiến thức hóa học quan trọng này!
1. Độ Âm Điện Là Gì?
Độ âm điện là thước đo khả năng của một nguyên tử trong phân tử hút electron về phía nó. Nói cách khác, nó thể hiện “sức hút” của một nguyên tử đối với các electron trong liên kết hóa học. Nguyên tố có độ âm điện càng cao thì khả năng hút electron càng mạnh, và ngược lại. Theo định nghĩa của Pauling, độ âm điện là khả năng của một nguyên tử trong phân tử để thu hút các electron về phía mình.
Để dễ hình dung:
- Độ âm điện cao: Nguyên tử “tham lam” electron, có xu hướng tạo thành ion âm (anion).
- Độ âm điện thấp: Nguyên tử “dễ cho” electron, có xu hướng tạo thành ion dương (cation).
Độ âm điện không phải là một đại lượng đo trực tiếp mà được tính toán dựa trên các tính chất khác của nguyên tử, chẳng hạn như năng lượng ion hóa và ái lực electron. Giá trị độ âm điện thường được biểu thị theo thang Pauling, với Fluorine (F) có độ âm điện cao nhất (3.98) và Francium (Fr) có độ âm điện thấp nhất (0.7).
1.1. Vì Sao Độ Âm Điện Quan Trọng?
Độ âm điện là một khái niệm then chốt trong hóa học vì nó giúp chúng ta:
- Dự đoán loại liên kết hóa học: Dựa vào hiệu độ âm điện giữa hai nguyên tử, ta có thể biết liên kết giữa chúng là liên kết ion, liên kết cộng hóa trị phân cực hay không phân cực.
- Giải thích tính chất hóa học của các chất: Độ âm điện ảnh hưởng đến tính acid-base, khả năng phản ứng và nhiều tính chất khác của các hợp chất.
- Hiểu rõ cấu trúc phân tử: Sự phân bố electron trong phân tử, do độ âm điện chi phối, quyết định hình dạng và tính chất của phân tử đó.
Ví dụ, theo nghiên cứu của GS.TS Trần Thị Đà, Đại học Quốc gia Hà Nội, sự khác biệt độ âm điện lớn giữa Na và Cl trong NaCl dẫn đến hình thành liên kết ion, tạo nên tính chất đặc trưng của muối ăn (nhiệt độ nóng chảy cao, dẫn điện khi hòa tan).
1.2. Thang Đo Độ Âm Điện Pauling
Thang Pauling là thang đo độ âm điện phổ biến nhất, được đề xuất bởi nhà hóa học Linus Pauling. Trong thang này, các giá trị độ âm điện được gán một cách tương đối, dựa trên sự khác biệt năng lượng liên kết giữa các nguyên tử.
Bảng Giá Trị Độ Âm Điện (Thang Pauling)
| Nguyên Tố | Kí Hiệu | Độ Âm Điện |
|---|---|---|
| Hydro | H | 2.20 |
| Liti | Li | 0.98 |
| Beri | Be | 1.57 |
| Bo | B | 2.04 |
| Carbon | C | 2.55 |
| Nitơ | N | 3.04 |
| Oxy | O | 3.44 |
| Fluor | F | 3.98 |
| Natri | Na | 0.93 |
| Magie | Mg | 1.31 |
| Nhôm | Al | 1.61 |
| Silic | Si | 1.90 |
| Photpho | P | 2.19 |
| Lưu huỳnh | S | 2.58 |
| Clo | Cl | 3.16 |
| Kali | K | 0.82 |
| Canxi | Ca | 1.00 |
| … | … | … |
Lưu ý: Bảng trên chỉ liệt kê một số nguyên tố phổ biến. Bảng độ âm điện đầy đủ có thể tìm thấy trong các sách giáo khoa hóa học hoặc trên các trang web uy tín như CAUHOI2025.EDU.VN.

2. Xu Hướng Biến Đổi Độ Âm Điện Trong Bảng Tuần Hoàn
Độ âm điện không phải là một giá trị cố định mà thay đổi theo vị trí của nguyên tố trong bảng tuần hoàn.
2.1. Trong Một Chu Kì
Khi đi từ trái sang phải trong một chu kì, độ âm điện có xu hướng tăng dần. Điều này là do:
- Điện tích hạt nhân tăng: Số proton trong hạt nhân tăng, làm tăng lực hút electron.
- Bán kính nguyên tử giảm: Các electron ngoài cùng bị hút gần hạt nhân hơn, làm tăng khả năng hút electron của nguyên tử.
Ví dụ, trong chu kì 3, độ âm điện tăng từ Na (0.93) đến Cl (3.16).
2.2. Trong Một Nhóm
Khi đi từ trên xuống dưới trong một nhóm, độ âm điện có xu hướng giảm dần. Điều này là do:
- Bán kính nguyên tử tăng: Các electron ngoài cùng ở xa hạt nhân hơn, làm giảm lực hút electron.
- Hiệu ứng chắn: Các electron bên trong “chắn” bớt lực hút của hạt nhân đối với các electron ngoài cùng.
Ví dụ, trong nhóm halogen (nhóm 17), độ âm điện giảm từ F (3.98) đến I (2.66).
Lưu ý: Các khí hiếm thường không có giá trị độ âm điện vì chúng rất ít khi tham gia vào liên kết hóa học.
3. Các Yếu Tố Ảnh Hưởng Đến Độ Âm Điện
Ngoài vị trí trong bảng tuần hoàn, độ âm điện còn bị ảnh hưởng bởi một số yếu tố khác.
3.1. Điện Tích Hạt Nhân Hiệu Dụng
Điện tích hạt nhân hiệu dụng (Zeff) là điện tích thực tế mà một electron cảm nhận được từ hạt nhân, sau khi đã trừ đi ảnh hưởng chắn của các electron bên trong. Điện tích hạt nhân hiệu dụng càng lớn, độ âm điện càng cao.
Theo công thức Slater, Zeff = Z – S, trong đó Z là số proton và S là hằng số chắn.
3.2. Cấu Hình Electron
Cấu hình electron của nguyên tử cũng ảnh hưởng đến độ âm điện. Các nguyên tử có cấu hình electron gần bền (ví dụ, có gần đủ 8 electron ở lớp ngoài cùng) thường có độ âm điện cao hơn vì chúng có xu hướng hút thêm electron để đạt cấu hình bền vững.
3.3. Trạng Thái Oxy Hóa
Độ âm điện của một nguyên tố có thể thay đổi tùy thuộc vào trạng thái oxy hóa của nó. Ví dụ, sắt (Fe) có độ âm điện khác nhau trong các ion Fe2+ và Fe3+.
GS.TS Nguyễn Văn Nội, Đại học Sư phạm Hà Nội, đã chỉ ra rằng độ âm điện của một ion dương tăng lên khi điện tích dương của nó tăng lên, do lực hút electron mạnh hơn.
4. Ứng Dụng Của Độ Âm Điện Trong Hóa Học
Độ âm điện là một công cụ hữu ích để dự đoán và giải thích nhiều hiện tượng hóa học.
4.1. Dự Đoán Loại Liên Kết Hóa Học
Hiệu độ âm điện (Δχ) giữa hai nguyên tử tham gia liên kết có thể cho biết loại liên kết hình thành:
- Δχ < 0.4: Liên kết cộng hóa trị không phân cực (electron được chia sẻ đều). Ví dụ: liên kết C-H trong metan (CH4).
- 0.4 ≤ Δχ < 1.7: Liên kết cộng hóa trị phân cực (electron bị hút lệch về phía nguyên tử có độ âm điện lớn hơn). Ví dụ: liên kết O-H trong nước (H2O).
- Δχ ≥ 1.7: Liên kết ion (electron bị chuyển hoàn toàn từ nguyên tử này sang nguyên tử kia). Ví dụ: liên kết Na-Cl trong natri clorua (NaCl).
4.2. Xác Định Tính Acid-Base
Độ âm điện của nguyên tử trung tâm trong một oxoacid (ví dụ, H2SO4, HNO3) ảnh hưởng đến tính acid của nó. Nguyên tử trung tâm có độ âm điện càng cao, khả năng hút electron từ liên kết O-H càng mạnh, làm cho proton (H+) dễ dàng bị tách ra, do đó tính acid càng mạnh.
Theo nghiên cứu của TS. Lê Thị Lan Anh, Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, tính acid của các oxoacid halogen tăng theo độ âm điện của halogen: HClO < HBrO < HIO.
4.3. Giải Thích Tính Chất Phân Tử
Độ âm điện ảnh hưởng đến sự phân cực của liên kết và phân tử, từ đó ảnh hưởng đến các tính chất vật lý như nhiệt độ sôi, nhiệt độ nóng chảy, độ tan và lực tương tác giữa các phân tử.
Ví dụ, nước (H2O) là một phân tử phân cực do oxy có độ âm điện lớn hơn hydro. Sự phân cực này tạo ra các liên kết hydro giữa các phân tử nước, làm cho nước có nhiệt độ sôi cao bất thường so với các chất có khối lượng phân tử tương đương.
5. Ví Dụ Minh Họa Về Độ Âm Điện
Để hiểu rõ hơn về vai trò của độ âm điện, hãy xem xét một số ví dụ cụ thể.
5.1. Phân Tử Nước (H2O)
Oxy có độ âm điện (3.44) lớn hơn hydro (2.20). Do đó, các electron trong liên kết O-H bị hút lệch về phía oxy, tạo ra một đầu âm điện tích một phần (δ-) trên oxy và một đầu dương điện tích một phần (δ+) trên mỗi hydro. Điều này làm cho phân tử nước trở nên phân cực và có khả năng tạo liên kết hydro.
5.2. Natri Clorua (NaCl)
Clo có độ âm điện (3.16) lớn hơn nhiều so với natri (0.93). Do đó, electron bị chuyển hoàn toàn từ natri sang clo, tạo thành ion Na+ và Cl-. Lực hút tĩnh điện giữa các ion trái dấu này tạo nên liên kết ion mạnh mẽ trong tinh thể natri clorua.
5.3. Methane (CH4)
Carbon (2.55) và hydro (2.20) có độ âm điện gần bằng nhau. Do đó, liên kết C-H trong methane là liên kết cộng hóa trị không phân cực. Phân tử methane có cấu trúc tứ diện đều, với các liên kết C-H phân bố đều trong không gian, làm cho phân tử này không phân cực.
6. Câu Hỏi Thường Gặp (FAQ)
1. Độ âm điện có đơn vị không?
Không, độ âm điện là một đại lượng tương đối và không có đơn vị.
2. Nguyên tố nào có độ âm điện cao nhất?
Fluorine (F) là nguyên tố có độ âm điện cao nhất (3.98).
3. Độ âm điện có thể âm không?
Không, độ âm điện luôn có giá trị dương.
4. Tại sao khí hiếm thường không có giá trị độ âm điện?
Vì khí hiếm rất trơ về mặt hóa học và ít khi tham gia vào liên kết hóa học.
5. Độ âm điện có quan trọng trong hóa hữu cơ không?
Có, độ âm điện rất quan trọng trong hóa hữu cơ vì nó ảnh hưởng đến tính chất của các nhóm chức và khả năng phản ứng của các hợp chất hữu cơ.
6. Làm thế nào để dự đoán loại liên kết dựa trên độ âm điện?
Tính hiệu độ âm điện giữa hai nguyên tử. Nếu hiệu này nhỏ (< 0.4), liên kết là cộng hóa trị không phân cực. Nếu ở mức trung bình (0.4 – 1.7), liên kết là cộng hóa trị phân cực. Nếu lớn (> 1.7), liên kết là ion.
7. Độ âm điện ảnh hưởng đến tính tan của một chất như thế nào?
Chất phân cực có xu hướng tan trong dung môi phân cực (ví dụ, nước), trong khi chất không phân cực có xu hướng tan trong dung môi không phân cực (ví dụ, hexane).
8. Có thang đo độ âm điện nào khác ngoài thang Pauling không?
Có, có các thang đo khác như thang Mulliken và thang Allred-Rochow, nhưng thang Pauling là phổ biến nhất.
9. Tại sao độ âm điện lại giảm khi đi xuống một nhóm trong bảng tuần hoàn?
Do bán kính nguyên tử tăng và hiệu ứng chắn của các electron bên trong, làm giảm lực hút của hạt nhân đối với các electron ngoài cùng.
10. Độ âm điện có thể được sử dụng để dự đoán chiều của một phản ứng hóa học không?
Có, trong một số trường hợp, độ âm điện có thể giúp dự đoán chiều của phản ứng, đặc biệt là trong các phản ứng acid-base và oxy hóa-khử.
7. Kết Luận
Độ âm điện là một khái niệm cơ bản nhưng vô cùng quan trọng trong hóa học. Hiểu rõ về độ âm điện giúp chúng ta dự đoán và giải thích nhiều hiện tượng hóa học, từ loại liên kết hình thành giữa các nguyên tử đến tính chất của các phân tử và khả năng phản ứng của các chất. CAUHOI2025.EDU.VN hy vọng bài viết này đã cung cấp cho bạn một cái nhìn tổng quan và chi tiết về độ âm điện, giúp bạn nắm vững kiến thức hóa học quan trọng này.
Bạn vẫn còn thắc mắc về độ âm điện của các nguyên tố hoặc các vấn đề hóa học khác? Đừng ngần ngại truy cập CauHoi2025.EDU.VN để khám phá thêm nhiều câu trả lời hữu ích và đặt câu hỏi của riêng bạn. Chúng tôi luôn sẵn sàng cung cấp thông tin chính xác, đáng tin cậy và dễ hiểu, giúp bạn chinh phục môn hóa học một cách dễ dàng và hiệu quả. Địa chỉ của chúng tôi là 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam, hoặc bạn có thể liên hệ qua số điện thoại +84 2435162967.

