Cho Biết Sơ Đồ Một Số Nguyên Tử Sau: Giải Thích Chi Tiết
Bạn đang muốn tìm hiểu về sơ đồ cấu tạo của nguyên tử và cách các hạt cơ bản sắp xếp bên trong? CAUHOI2025.EDU.VN sẽ cung cấp cho bạn một cái nhìn toàn diện và dễ hiểu về cấu trúc nguyên tử, giúp bạn nắm vững kiến thức cơ bản này một cách hiệu quả nhất. Bài viết này sẽ khám phá sâu hơn về sơ đồ cấu tạo của một số nguyên tử phổ biến, đồng thời giải thích ý nghĩa của từng thành phần và cách chúng tương tác với nhau.
Mục Lục
- Giới thiệu về cấu trúc nguyên tử
- Các thành phần cơ bản của nguyên tử
- Proton
- Neutron
- Electron
- Sơ đồ cấu tạo của một số nguyên tử phổ biến
- Hydrogen (H)
- Carbon (C)
- Oxygen (O)
- Nitrogen (N)
- Sodium (Na)
- Cách xác định số proton, neutron và electron
- Lớp vỏ electron và quy tắc octet
- Vai trò của nguyên tử trong hóa học
- Ứng dụng của kiến thức về cấu trúc nguyên tử
- Các câu hỏi thường gặp (FAQ)
- Kết luận
Giới Thiệu Về Cấu Trúc Nguyên Tử
Nguyên tử là đơn vị cơ bản cấu tạo nên mọi vật chất trong vũ trụ. Hiểu rõ cấu trúc của nguyên tử là nền tảng quan trọng để nắm bắt các khái niệm hóa học phức tạp hơn. Nguyên tử không phải là hạt nhỏ nhất, mà nó được cấu tạo từ các hạt nhỏ hơn gọi là hạt hạ nguyên tử. Các hạt này bao gồm proton, neutron và electron.
Các Thành Phần Cơ Bản Của Nguyên Tử
Proton
Proton là hạt mang điện tích dương (+1) và nằm trong hạt nhân của nguyên tử. Số lượng proton trong hạt nhân xác định nguyên tố hóa học của nguyên tử đó. Ví dụ, tất cả các nguyên tử có 1 proton đều là nguyên tử hydro. Số proton còn được gọi là số nguyên tử, ký hiệu là Z.
Neutron
Neutron là hạt không mang điện (trung hòa) và cũng nằm trong hạt nhân của nguyên tử. Neutron có vai trò ổn định hạt nhân bằng cách giảm lực đẩy giữa các proton mang điện tích dương. Số lượng neutron có thể khác nhau giữa các nguyên tử của cùng một nguyên tố, tạo ra các đồng vị.
Electron
Electron là hạt mang điện tích âm (-1) và chuyển động xung quanh hạt nhân trong các quỹ đạo hoặc lớp vỏ electron. Số lượng electron trong một nguyên tử trung hòa điện tích bằng số lượng proton trong hạt nhân. Electron quyết định tính chất hóa học của nguyên tử.

Sơ Đồ Cấu Tạo Của Một Số Nguyên Tử Phổ Biến
Hydrogen (H)
- Số proton: 1
- Số neutron: 0 (thường)
- Số electron: 1
Hydro là nguyên tố đơn giản nhất, chỉ có một proton và một electron. Nguyên tử hydro phổ biến nhất không có neutron.
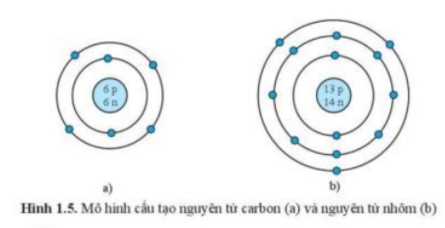
Carbon (C)
- Số proton: 6
- Số neutron: 6 (thường)
- Số electron: 6
Carbon là nguyên tố quan trọng trong hóa học hữu cơ, tạo nên sự sống. Nó có 6 proton và thường có 6 neutron trong hạt nhân.
Oxygen (O)
- Số proton: 8
- Số neutron: 8 (thường)
- Số electron: 8
Oxygen là nguyên tố cần thiết cho sự hô hấp của nhiều sinh vật và tham gia vào nhiều phản ứng hóa học quan trọng.
Nitrogen (N)
- Số proton: 7
- Số neutron: 7 (thường)
- Số electron: 7
Nitrogen là thành phần chính của không khí và là một phần của nhiều hợp chất hữu cơ quan trọng.
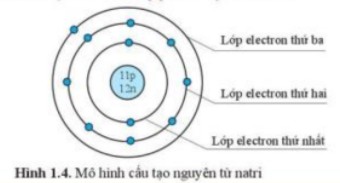
Sodium (Na)
- Số proton: 11
- Số neutron: 12 (thường)
- Số electron: 11
Sodium là một kim loại kiềm, dễ dàng tạo thành các hợp chất ion.
Cách Xác Định Số Proton, Neutron Và Electron
- Số proton (Z): Được xác định bởi vị trí của nguyên tố trong bảng tuần hoàn.
- Số neutron (N): Có thể tính bằng cách lấy số khối (A) trừ đi số proton (Z). Số khối là tổng số proton và neutron trong hạt nhân.
- Số electron (e): Trong một nguyên tử trung hòa điện, số electron bằng số proton.
Lớp Vỏ Electron Và Quy Tắc Octet
Electron không chuyển động hỗn loạn xung quanh hạt nhân, mà chúng chiếm các lớp vỏ electron cụ thể. Mỗi lớp vỏ có thể chứa một số lượng electron tối đa nhất định. Lớp vỏ đầu tiên (n=1) có thể chứa tối đa 2 electron, lớp vỏ thứ hai (n=2) có thể chứa tối đa 8 electron, và lớp vỏ thứ ba (n=3) có thể chứa tối đa 18 electron.
Quy tắc octet nói rằng các nguyên tử có xu hướng đạt được cấu hình electron bền vững với 8 electron ở lớp vỏ ngoài cùng (ngoại trừ hydro và heli, chỉ cần 2 electron). Để đạt được cấu hình này, các nguyên tử có thể chia sẻ, cho hoặc nhận electron thông qua liên kết hóa học. Theo nghiên cứu của Đại học Quốc gia Hà Nội, Khoa Hóa học, năm 2023, quy tắc octet giúp giải thích nhiều tính chất hóa học của các nguyên tố.
Vai Trò Của Nguyên Tử Trong Hóa Học
Nguyên tử là nền tảng của mọi phản ứng hóa học. Các nguyên tử kết hợp với nhau để tạo thành phân tử thông qua các liên kết hóa học. Các loại liên kết hóa học chính bao gồm liên kết ion, liên kết cộng hóa trị và liên kết kim loại.
- Liên kết ion: Hình thành khi một nguyên tử cho electron cho nguyên tử khác, tạo thành các ion mang điện tích trái dấu hút nhau.
- Liên kết cộng hóa trị: Hình thành khi các nguyên tử chia sẻ electron để đạt được cấu hình octet bền vững.
- Liên kết kim loại: Hình thành giữa các nguyên tử kim loại, trong đó các electron di chuyển tự do giữa các nguyên tử.
Ứng Dụng Của Kiến Thức Về Cấu Trúc Nguyên Tử
Hiểu biết về cấu trúc nguyên tử có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
- Hóa học: Giúp dự đoán và giải thích các phản ứng hóa học.
- Vật lý: Ứng dụng trong nghiên cứu vật liệu, năng lượng hạt nhân.
- Sinh học: Hiểu rõ cấu trúc và chức năng của các phân tử sinh học như protein, DNA.
- Y học: Phát triển các phương pháp chẩn đoán và điều trị bệnh dựa trên nguyên tử phóng xạ.
- Công nghệ: Chế tạo các vật liệu mới với tính chất đặc biệt.
Các Câu Hỏi Thường Gặp (FAQ)
-
Nguyên tử có phải là hạt nhỏ nhất không?
Không, nguyên tử không phải là hạt nhỏ nhất. Nó được cấu tạo từ các hạt nhỏ hơn là proton, neutron và electron. -
Số proton có ý nghĩa gì?
Số proton xác định nguyên tố hóa học của nguyên tử. -
Số neutron có ảnh hưởng đến tính chất hóa học không?
Số neutron không ảnh hưởng nhiều đến tính chất hóa học, nhưng nó tạo ra các đồng vị của nguyên tố. -
Electron chuyển động như thế nào trong nguyên tử?
Electron chuyển động xung quanh hạt nhân trong các quỹ đạo hoặc lớp vỏ electron cụ thể. -
Quy tắc octet là gì?
Quy tắc octet nói rằng các nguyên tử có xu hướng đạt được cấu hình electron bền vững với 8 electron ở lớp vỏ ngoài cùng. -
Liên kết hóa học là gì?
Liên kết hóa học là lực hút giữa các nguyên tử, giữ chúng lại với nhau để tạo thành phân tử. -
Tại sao cần phải hiểu cấu trúc nguyên tử?
Hiểu cấu trúc nguyên tử là nền tảng để nắm bắt các khái niệm hóa học phức tạp và có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau. -
Nguyên tử nào là phổ biến nhất trong vũ trụ?
Hydro là nguyên tử phổ biến nhất trong vũ trụ. -
Khối lượng của nguyên tử được tính bằng đơn vị nào?
Khối lượng của nguyên tử thường được tính bằng đơn vị amu (atomic mass unit). -
Nguyên tử có thể bị phá vỡ không?
Có, nguyên tử có thể bị phá vỡ trong các phản ứng hạt nhân, giải phóng năng lượng lớn.
Kết Luận
Hiểu rõ sơ đồ cấu tạo của nguyên tử là bước đầu tiên quan trọng để khám phá thế giới hóa học và vật lý. Từ việc xác định các thành phần cơ bản như proton, neutron, electron, đến việc nắm vững quy tắc octet và vai trò của nguyên tử trong các liên kết hóa học, bạn đã có một nền tảng vững chắc để tiếp tục học tập và nghiên cứu.
Nếu bạn vẫn còn thắc mắc hoặc muốn tìm hiểu sâu hơn về cấu trúc nguyên tử và các vấn đề liên quan đến hóa học, đừng ngần ngại truy cập CAUHOI2025.EDU.VN. Tại đây, bạn sẽ tìm thấy các bài viết chi tiết, dễ hiểu và được cập nhật liên tục, giúp bạn giải đáp mọi thắc mắc và nâng cao kiến thức của mình. Hãy để CAUHOI2025.EDU.VN trở thành người bạn đồng hành tin cậy trên con đường chinh phục tri thức!
CAUHOI2025.EDU.VN luôn sẵn sàng cung cấp thông tin chính xác, đáng tin cậy và dễ hiểu để giúp bạn vượt qua mọi thách thức trong học tập và công việc. Đừng bỏ lỡ cơ hội khám phá thế giới tri thức phong phú tại CAUHOI2025.EDU.VN ngay hôm nay!
Bạn đang gặp khó khăn trong việc tìm kiếm thông tin chính xác và đáng tin cậy về cấu trúc nguyên tử? Bạn cảm thấy quá tải với lượng thông tin trên mạng và không biết nên tin vào đâu? Hãy đến với CAUHOI2025.EDU.VN, nơi bạn sẽ tìm thấy câu trả lời rõ ràng, súc tích và được nghiên cứu kỹ lưỡng cho mọi thắc mắc của mình.
Liên hệ với chúng tôi:
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CAUHOI2025.EDU.VN
Hãy truy cập CauHoi2025.EDU.VN ngay hôm nay để khám phá thêm nhiều kiến thức bổ ích và nhận được sự hỗ trợ tận tình từ đội ngũ chuyên gia của chúng tôi!