**Số Thứ Tự Của Nhóm Cho Biết Điều Gì? Giải Đáp Chi Tiết**
Bạn đang thắc mắc số thứ tự của nhóm trong bảng tuần hoàn hóa học cho biết điều gì? Số Thứ Tự Của Nhóm Cho Biết số electron hóa trị của các nguyên tố trong nhóm đó. Để hiểu rõ hơn về ý nghĩa và ứng dụng của thông tin này, hãy cùng CAUHOI2025.EDU.VN khám phá chi tiết trong bài viết dưới đây. Chúng tôi sẽ cung cấp cho bạn một cái nhìn toàn diện, dễ hiểu và hữu ích, giúp bạn nắm vững kiến thức hóa học một cách hiệu quả nhất.
1. Bảng Tuần Hoàn Hóa Học: Tổng Quan
Bảng tuần hoàn các nguyên tố hóa học, hay còn gọi là bảng tuần hoàn Mendeleev, là một hệ thống sắp xếp các nguyên tố dựa trên tính chất hóa học và vật lý của chúng. Bảng tuần hoàn là một công cụ vô cùng quan trọng trong hóa học, giúp chúng ta dự đoán và hiểu rõ hơn về các phản ứng hóa học, cấu trúc nguyên tử, và nhiều khía cạnh khác của thế giới vật chất.
1.1. Nguyên Tắc Sắp Xếp
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo ba nguyên tắc chính:
- Nguyên tắc 1: Theo chiều tăng dần của điện tích hạt nhân (số proton).
- Nguyên tắc 2: Các nguyên tố có cùng số lớp electron được xếp thành một hàng ngang, gọi là chu kỳ.
- Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị (electron lớp ngoài cùng) được xếp thành một cột dọc, gọi là nhóm.
1.2. Cấu Trúc Bảng Tuần Hoàn
Bảng tuần hoàn gồm có:
-
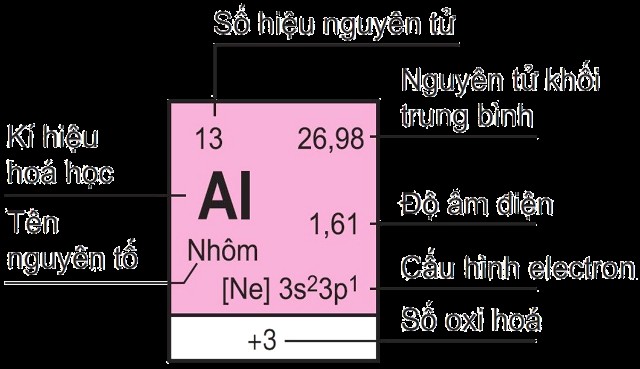
Ô nguyên tố: Mỗi ô chứa thông tin về một nguyên tố, bao gồm ký hiệu hóa học, số nguyên tử, khối lượng nguyên tử, và một số thông tin khác. Số thứ tự của ô nguyên tố trùng với số hiệu nguyên tử của nguyên tố đó.

-
Chu kỳ: Có 7 chu kỳ, được đánh số từ 1 đến 7. Số thứ tự của chu kỳ cho biết số lớp electron của nguyên tử các nguyên tố trong chu kỳ đó.
-
Nhóm: Có 18 nhóm, được chia thành hai loại chính: nhóm A (nhóm chính) và nhóm B (nhóm chuyển tiếp).
- Nhóm A: Gồm 8 nhóm, được đánh số từ IA đến VIIIA. Các nguyên tố trong nhóm A có cấu hình electron lớp ngoài cùng tương tự nhau, do đó có tính chất hóa học tương đồng.
- Nhóm B: Gồm 10 nhóm, được đánh số từ IIIB đến IIB. Các nguyên tố trong nhóm B là các kim loại chuyển tiếp, có tính chất hóa học phức tạp hơn.
2. Số Thứ Tự Của Nhóm Cho Biết Điều Gì?
Số thứ tự của nhóm (đặc biệt là đối với các nhóm A) cho biết số electron hóa trị của các nguyên tố trong nhóm đó.
2.1. Electron Hóa Trị Là Gì?
Electron hóa trị là các electron nằm ở lớp vỏ ngoài cùng của một nguyên tử và có khả năng tham gia vào việc hình thành liên kết hóa học. Số lượng electron hóa trị quyết định hóa trị của nguyên tố, tức là khả năng liên kết của nguyên tố đó với các nguyên tố khác.
2.2. Mối Liên Hệ Giữa Số Thứ Tự Nhóm và Electron Hóa Trị
- Nhóm IA (kim loại kiềm): Các nguyên tố trong nhóm này có 1 electron hóa trị (ns¹). Ví dụ: Natri (Na) có cấu hình electron là 1s² 2s² 2p⁶ 3s¹, có 1 electron hóa trị ở lớp 3s.
- Nhóm IIA (kim loại kiềm thổ): Các nguyên tố trong nhóm này có 2 electron hóa trị (ns²). Ví dụ: Magie (Mg) có cấu hình electron là 1s² 2s² 2p⁶ 3s², có 2 electron hóa trị ở lớp 3s.
- Nhóm IIIA: Các nguyên tố trong nhóm này có 3 electron hóa trị (ns² np¹). Ví dụ: Nhôm (Al) có cấu hình electron là 1s² 2s² 2p⁶ 3s² 3p¹, có 3 electron hóa trị ở lớp 3s và 3p.
- Nhóm IVA: Các nguyên tố trong nhóm này có 4 electron hóa trị (ns² np²). Ví dụ: Cacbon (C) có cấu hình electron là 1s² 2s² 2p², có 4 electron hóa trị ở lớp 2s và 2p.
- Nhóm VA: Các nguyên tố trong nhóm này có 5 electron hóa trị (ns² np³). Ví dụ: Nitơ (N) có cấu hình electron là 1s² 2s² 2p³, có 5 electron hóa trị ở lớp 2s và 2p.
- Nhóm VIA: Các nguyên tố trong nhóm này có 6 electron hóa trị (ns² np⁴). Ví dụ: Oxi (O) có cấu hình electron là 1s² 2s² 2p⁴, có 6 electron hóa trị ở lớp 2s và 2p.
- Nhóm VIIA (halogen): Các nguyên tố trong nhóm này có 7 electron hóa trị (ns² np⁵). Ví dụ: Clo (Cl) có cấu hình electron là 1s² 2s² 2p⁶ 3s² 3p⁵, có 7 electron hóa trị ở lớp 3s và 3p.
- Nhóm VIIIA (khí hiếm): Các nguyên tố trong nhóm này có 8 electron hóa trị (ns² np⁶), trừ Heli (He) chỉ có 2 electron hóa trị. Các khí hiếm có lớp vỏ electron ngoài cùng bão hòa, nên rất khó tham gia vào các phản ứng hóa học.
2.3. Ý Nghĩa Của Việc Biết Số Electron Hóa Trị
Biết số electron hóa trị của một nguyên tố cho phép chúng ta dự đoán:
- Hóa trị của nguyên tố: Số electron hóa trị thường quyết định hóa trị của nguyên tố trong các hợp chất. Ví dụ, các nguyên tố nhóm IA thường có hóa trị +1, nhóm IIA thường có hóa trị +2, nhóm VIIA thường có hóa trị -1.
- Khả năng tạo liên kết hóa học: Các nguyên tố có xu hướng tạo liên kết hóa học để đạt được cấu hình electron bền vững, thường là cấu hình của khí hiếm (8 electron hóa trị).
- Tính chất hóa học của nguyên tố: Các nguyên tố trong cùng một nhóm có tính chất hóa học tương tự nhau do có cùng số electron hóa trị.
3. Cách Xác Định Nhóm Của Một Nguyên Tố
Để xác định nhóm của một nguyên tố, ta cần:
- Xác định cấu hình electron của nguyên tố.
- Xác định số electron hóa trị (electron ở lớp ngoài cùng).
- Đối với các nguyên tố nhóm A: Số electron hóa trị bằng số thứ tự của nhóm.
- Đối với các nguyên tố nhóm B: Xác định theo quy tắc phức tạp hơn, liên quan đến số electron ở lớp (n-1)d và ns.
3.1. Ví Dụ Minh Họa
- Ví dụ 1: Xác định nhóm của nguyên tố Kali (K) có số hiệu nguyên tử Z = 19.
- Cấu hình electron của K: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
- Số electron hóa trị: 1 (ở lớp 4s)
- Vậy Kali thuộc nhóm IA (kim loại kiềm).
- Ví dụ 2: Xác định nhóm của nguyên tố Oxi (O) có số hiệu nguyên tử Z = 8.
- Cấu hình electron của O: 1s² 2s² 2p⁴
- Số electron hóa trị: 6 (ở lớp 2s và 2p)
- Vậy Oxi thuộc nhóm VIA (chalcogen).
3.2. Lưu Ý Đối Với Nhóm B
Việc xác định nhóm của các nguyên tố nhóm B (kim loại chuyển tiếp) phức tạp hơn do có sự tham gia của electron ở lớp (n-1)d. Một số quy tắc chung:
- Nếu tổng số electron (n-1)d + ns ≤ 8: Số thứ tự của nhóm bằng tổng số electron này.
- Nếu tổng số electron (n-1)d + ns = 9 hoặc 10: Nguyên tố thuộc nhóm VIIIB.
- Nếu tổng số electron (n-1)d + ns = 11: Nguyên tố thuộc nhóm IB.
- Nếu tổng số electron (n-1)d + ns = 12: Nguyên tố thuộc nhóm IIB.
Ví dụ, Crom (Cr) có cấu hình electron là [Ar] 3d⁵ 4s¹, có tổng số electron 3d + 4s = 6, vậy Crom thuộc nhóm VIB.
4. Bài Tập Vận Dụng
Để củng cố kiến thức, hãy cùng CAUHOI2025.EDU.VN làm một số bài tập sau:
Câu 1: Nguyên tố X có cấu hình electron là 1s² 2s² 2p⁶ 3s² 3p⁵. Xác định vị trí của X trong bảng tuần hoàn.
Câu 2: Nguyên tố Y thuộc chu kỳ 4, nhóm VIA. Viết cấu hình electron của Y.
Câu 3: Cho các nguyên tố Na (Z=11), Mg (Z=12), Al (Z=13), Si (Z=14). Sắp xếp các nguyên tố này theo chiều tăng dần tính kim loại. Giải thích.
Gợi ý trả lời:
- Câu 1: X có 17 electron, thuộc chu kỳ 3, nhóm VIIA (halogen).
- Câu 2: Y thuộc chu kỳ 4, nhóm VIA, nên có cấu hình electron là 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁴.
- Câu 3: Na > Mg > Al > Si. Tính kim loại giảm dần từ trái sang phải trong một chu kỳ do điện tích hạt nhân tăng, lực hút giữa hạt nhân và electron lớp ngoài cùng tăng.
5. Tầm Quan Trọng Của Bảng Tuần Hoàn Trong Hóa Học
Bảng tuần hoàn không chỉ là một bảng liệt kê các nguyên tố, mà còn là một công cụ mạnh mẽ giúp chúng ta:
- Dự đoán tính chất hóa học: Dựa vào vị trí của một nguyên tố trong bảng tuần hoàn, ta có thể dự đoán được tính chất hóa học của nó, như khả năng tạo liên kết, tính axit-bazơ của oxit và hidroxit, v.v.
- Hiểu rõ cấu trúc nguyên tử: Bảng tuần hoàn giúp ta hiểu rõ hơn về cấu hình electron của các nguyên tử, từ đó giải thích được nhiều hiện tượng hóa học phức tạp.
- Nghiên cứu và phát triển vật liệu mới: Bảng tuần hoàn là cơ sở để các nhà khoa học nghiên cứu và phát triển các vật liệu mới với tính chất đặc biệt, ứng dụng trong nhiều lĩnh vực như điện tử, y học, năng lượng, v.v.
Theo một nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội, việc nắm vững bảng tuần hoàn là yếu tố then chốt để học tốt môn Hóa học ở bậc phổ thông và đại học. Sinh viên nắm vững bảng tuần hoàn có khả năng giải quyết các bài toán hóa học phức tạp nhanh chóng và chính xác hơn.
6. Ứng Dụng Thực Tiễn Của Bảng Tuần Hoàn
Bảng tuần hoàn có mặt ở khắp mọi nơi trong cuộc sống, từ phòng thí nghiệm đến các ngành công nghiệp. Một số ứng dụng tiêu biểu:
- Y học: Các nguyên tố như Iốt (I), Sắt (Fe), Kẽm (Zn) đóng vai trò quan trọng trong cơ thể con người. Bảng tuần hoàn giúp các nhà khoa học hiểu rõ hơn về vai trò của các nguyên tố này và phát triển các loại thuốc hiệu quả.
- Nông nghiệp: Các nguyên tố như Nitơ (N), Phốt pho (P), Kali (K) là thành phần chính của phân bón. Bảng tuần hoàn giúp nông dân lựa chọn loại phân bón phù hợp để tăng năng suất cây trồng.
- Công nghiệp: Các nguyên tố như Silic (Si), Germani (Ge) là vật liệu bán dẫn quan trọng trong công nghiệp điện tử. Bảng tuần hoàn giúp các kỹ sư thiết kế các thiết bị điện tử ngày càng nhỏ gọn và mạnh mẽ hơn.
7. Câu Hỏi Thường Gặp (FAQ)
Câu 1: Số thứ tự của chu kỳ cho biết điều gì?
Số thứ tự của chu kỳ cho biết số lớp electron của nguyên tử các nguyên tố trong chu kỳ đó.
Câu 2: Các nguyên tố trong cùng một nhóm có tính chất hóa học giống nhau không?
Các nguyên tố trong cùng một nhóm thường có tính chất hóa học tương tự nhau do có cùng số electron hóa trị.
Câu 3: Tại sao các khí hiếm lại trơ về mặt hóa học?
Các khí hiếm có lớp vỏ electron ngoài cùng bão hòa (8 electron, trừ Heli có 2 electron), nên rất khó tham gia vào các phản ứng hóa học.
Câu 4: Electron hóa trị có vai trò gì?
Electron hóa trị quyết định hóa trị của nguyên tố và khả năng tạo liên kết hóa học.
Câu 5: Bảng tuần hoàn có bao nhiêu nhóm và bao nhiêu chu kỳ?
Bảng tuần hoàn có 18 nhóm và 7 chu kỳ.
Câu 6: Làm thế nào để xác định vị trí của một nguyên tố trong bảng tuần hoàn?
Để xác định vị trí của một nguyên tố, ta cần biết số hiệu nguyên tử (Z) và cấu hình electron của nguyên tố đó.
Câu 7: Tại sao bảng tuần hoàn lại quan trọng trong hóa học?
Bảng tuần hoàn giúp chúng ta dự đoán tính chất hóa học, hiểu rõ cấu trúc nguyên tử, và nghiên cứu phát triển vật liệu mới.
Câu 8: Nhóm A và nhóm B khác nhau như thế nào?
Nhóm A là các nhóm chính, có cấu hình electron lớp ngoài cùng tương tự nhau. Nhóm B là các nhóm chuyển tiếp, có tính chất hóa học phức tạp hơn.
Câu 9: Số electron hóa trị của nhóm VIIA là bao nhiêu?
Số electron hóa trị của nhóm VIIA (halogen) là 7.
Câu 10: Nguyên tố nào có số electron hóa trị là 6?
Các nguyên tố thuộc nhóm VIA (chalcogen) có số electron hóa trị là 6, ví dụ như Oxi (O), Lưu huỳnh (S).
8. Tìm Hiểu Thêm Tại CAUHOI2025.EDU.VN
Bạn muốn khám phá sâu hơn về bảng tuần hoàn và các nguyên tố hóa học? Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay! Chúng tôi cung cấp một nguồn tài nguyên phong phú với các bài viết chi tiết, dễ hiểu, được biên soạn bởi đội ngũ chuyên gia hàng đầu. Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Lời giải đáp cho mọi thắc mắc: Bất kể câu hỏi của bạn là gì, CAUHOI2025.EDU.VN luôn sẵn sàng cung cấp câu trả lời chính xác và đầy đủ nhất.
- Thông tin đáng tin cậy: Chúng tôi chỉ sử dụng các nguồn thông tin uy tín, được kiểm chứng kỹ lưỡng, đảm bảo bạn luôn nhận được thông tin chính xác và cập nhật nhất.
- Giao diện thân thiện, dễ sử dụng: CAUHOI2025.EDU.VN được thiết kế để mang lại trải nghiệm tốt nhất cho người dùng, giúp bạn dễ dàng tìm kiếm và tiếp thu kiến thức.
Đừng bỏ lỡ cơ hội nâng cao kiến thức hóa học của bạn! Hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay và khám phá thế giới hóa học đầy thú vị.
Nếu bạn có bất kỳ câu hỏi nào hoặc cần tư vấn thêm, đừng ngần ngại liên hệ với chúng tôi theo địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc qua số điện thoại: +84 2435162967. Bạn cũng có thể truy cập trang “Liên hệ” trên website CAUHOI2025.EDU.VN để gửi tin nhắn cho chúng tôi.
CauHoi2025.EDU.VN – Nơi giải đáp mọi thắc mắc của bạn!
