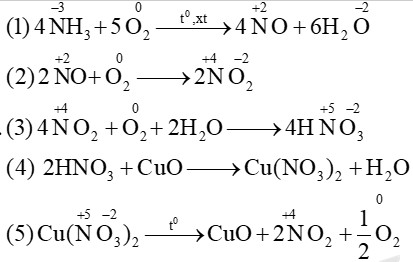
Phản Ứng Nào Sau Đây HCl Thể Hiện Tính Oxi Hóa? Giải Thích Chi Tiết
Bạn đang gặp khó khăn trong việc xác định khi nào axit clohydric (HCl) thể hiện tính oxi hóa? CAUHOI2025.EDU.VN sẽ giúp bạn hiểu rõ bản chất của phản ứng oxi hóa – khử và cách nhận biết vai trò của HCl trong các phản ứng hóa học khác nhau, từ đó nắm vững kiến thức và tự tin giải quyết mọi bài tập liên quan.
Tính Oxi Hóa – Khử và Vai Trò của HCl
Để hiểu rõ khi nào HCl thể hiện tính oxi hóa, chúng ta cần nắm vững các khái niệm cơ bản về phản ứng oxi hóa – khử (hay còn gọi là phản ứng redox):
- Chất oxi hóa: Là chất nhận electron trong phản ứng, làm giảm số oxi hóa của chính nó.
- Chất khử: Là chất nhường electron trong phản ứng, làm tăng số oxi hóa của chính nó.
- Phản ứng oxi hóa – khử: Là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một hoặc nhiều nguyên tố.
HCl có thể đóng vai trò là chất oxi hóa hoặc chất khử tùy thuộc vào chất phản ứng cùng. Để HCl thể hiện tính oxi hóa, nguyên tố hydro (H) trong HCl phải nhận electron để giảm số oxi hóa của nó.
HCl Thể Hiện Tính Oxi Hóa Trong Trường Hợp Nào?
HCl thể hiện tính oxi hóa khi tác dụng với các chất khử mạnh, đặc biệt là các kim loại có tính khử mạnh hơn hydro (H) trong dãy điện hóa. Trong trường hợp này, ion H+ trong HCl sẽ nhận electron từ kim loại để tạo thành khí hydro (H2).
Ví dụ điển hình:
2HCl + Mg → MgCl2 + H2Trong phản ứng này:
- Magie (Mg) là chất khử, nhường 2 electron để trở thành ion Mg2+. Số oxi hóa của Mg tăng từ 0 lên +2.
- HCl là chất oxi hóa, ion H+ nhận 2 electron để tạo thành khí H2. Số oxi hóa của H giảm từ +1 xuống 0.
Phân Tích Chi Tiết Các Trường Hợp HCl Thể Hiện Tính Oxi Hóa
Để làm rõ hơn, chúng ta sẽ đi sâu vào phân tích một số phản ứng cụ thể để xác định vai trò của HCl:
1. Phản Ứng Của HCl Với Kim Loại
Đây là trường hợp phổ biến nhất khi HCl thể hiện tính oxi hóa. Các kim loại như magie (Mg), kẽm (Zn), sắt (Fe),… có khả năng khử H+ trong HCl thành khí H2.
Ví dụ:
2HCl + Zn → ZnCl2 + H22HCl + Fe → FeCl2 + H2
Trong các phản ứng này, kim loại nhường electron cho H+ trong HCl, do đó HCl đóng vai trò là chất oxi hóa.
2. Phản Ứng Của HCl Với Một Số Hợp Chất Khử
Trong một số trường hợp, HCl cũng có thể thể hiện tính oxi hóa khi tác dụng với các hợp chất có tính khử. Tuy nhiên, các phản ứng này ít phổ biến hơn so với phản ứng với kim loại.
3. Phản Ứng HCl Không Thể Hiện Tính Oxi Hóa
Cần lưu ý rằng không phải trong mọi phản ứng HCl đều thể hiện tính oxi hóa. Trong nhiều trường hợp, HCl chỉ đóng vai trò là axit thông thường, cung cấp ion H+ để trung hòa bazơ hoặc tạo muối.
Ví dụ:
HCl + NaOH → NaCl + H2O(HCl là axit, NaOH là bazơ)HCl + AgNO3 → AgCl + HNO3(HCl cung cấp Cl- để tạo kết tủa AgCl)
Trong các phản ứng này, số oxi hóa của các nguyên tố không thay đổi, do đó không có sự oxi hóa – khử và HCl không đóng vai trò là chất oxi hóa.
Các Yếu Tố Ảnh Hưởng Đến Tính Oxi Hóa Của HCl
Một số yếu tố có thể ảnh hưởng đến khả năng thể hiện tính oxi hóa của HCl:
- Nồng độ HCl: HCl đặc thường có tính oxi hóa mạnh hơn HCl loãng.
- Nhiệt độ: Nhiệt độ cao có thể làm tăng tốc độ phản ứng và khả năng oxi hóa của HCl.
- Sự có mặt của chất xúc tác: Một số chất xúc tác có thể làm tăng khả năng oxi hóa của HCl.
Bài Tập Vận Dụng: Xác Định HCl Là Chất Oxi Hóa Hay Chất Khử
Để củng cố kiến thức, chúng ta hãy cùng xem xét một số ví dụ và xác định vai trò của HCl trong từng phản ứng:
Ví dụ 1:
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Trong phản ứng này, mangan (Mn) giảm số oxi hóa từ +4 xuống +2, clo (Cl) tăng số oxi hóa từ -1 lên 0. Vậy HCl là chất khử.
Ví dụ 2:
2HCl + FeS → FeCl2 + H2S
Trong phản ứng này, không có sự thay đổi số oxi hóa của các nguyên tố. HCl chỉ đóng vai trò là axit, do đó không thể hiện tính oxi hóa hay khử.
Các Ứng Dụng Quan Trọng Của Phản Ứng HCl Thể Hiện Tính Oxi Hóa
Phản ứng HCl thể hiện tính oxi hóa có nhiều ứng dụng quan trọng trong công nghiệp và đời sống:
- Sản xuất khí hydro (H2): Phản ứng của HCl với kim loại được sử dụng để sản xuất khí hydro trong phòng thí nghiệm và công nghiệp.
- Tẩy rửa kim loại: HCl được sử dụng để loại bỏ gỉ sét và các oxit kim loại trên bề mặt kim loại.
- Điều chế muối clorua: Phản ứng của HCl với kim loại hoặc oxit kim loại tạo ra các muối clorua, có nhiều ứng dụng trong các ngành công nghiệp khác nhau.
Nghiên Cứu Của Các Trường Đại Học Tại Việt Nam Về Ứng Dụng Của HCl
Các trường đại học và viện nghiên cứu tại Việt Nam đã có nhiều nghiên cứu về ứng dụng của HCl trong các lĩnh vực khác nhau. Ví dụ, một nghiên cứu của Đại học Bách Khoa Hà Nội đã chỉ ra rằng HCl có thể được sử dụng để xử lý chất thải công nghiệp chứa kim loại nặng, giúp giảm thiểu ô nhiễm môi trường.
Bảng Tóm Tắt Vai Trò Của HCl Trong Các Phản Ứng
Để dễ dàng ghi nhớ và so sánh, chúng ta có thể tóm tắt vai trò của HCl trong các phản ứng khác nhau trong bảng sau:
| Phản Ứng | Vai Trò Của HCl | Giải Thích |
|---|---|---|
| HCl + Kim loại (Mg, Zn, Fe,…) | Chất oxi hóa | H+ trong HCl nhận electron từ kim loại, tạo thành H2. |
| HCl + Bazơ (NaOH, KOH,…) | Axit | HCl cung cấp H+ để trung hòa bazơ, tạo thành muối và nước. |
| HCl + Muối (AgNO3,…) | Axit | HCl cung cấp Cl- để tạo kết tủa hoặc tham gia phản ứng trao đổi ion. |
| HCl + Chất oxi hóa (MnO2, KMnO4,…) | Chất khử | Cl- trong HCl nhường electron cho chất oxi hóa, tạo thành Cl2 hoặc các sản phẩm khác. |
| HCl + Hợp chất có tính khử (FeS,…) | Axit/Khử | Tùy thuộc vào điều kiện phản ứng và bản chất của hợp chất khử, HCl có thể đóng vai trò là axit hoặc chất khử. |
Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng Của HCl
-
Khi nào HCl là chất oxi hóa?
HCl là chất oxi hóa khi tác dụng với các chất khử mạnh, đặc biệt là kim loại, trong đó ion H+ nhận electron để tạo thành khí H2. -
Khi nào HCl là chất khử?
HCl là chất khử khi tác dụng với các chất oxi hóa mạnh, trong đó ion Cl- nhường electron để tạo thành khí Cl2. -
Làm thế nào để phân biệt HCl là chất oxi hóa hay chất khử trong một phản ứng?
Bạn cần xác định sự thay đổi số oxi hóa của các nguyên tố trong phản ứng. Nếu số oxi hóa của H giảm, HCl là chất oxi hóa. Nếu số oxi hóa của Cl tăng, HCl là chất khử. -
HCl đặc và HCl loãng, loại nào có tính oxi hóa mạnh hơn?
HCl đặc thường có tính oxi hóa mạnh hơn HCl loãng do nồng độ ion H+ cao hơn. -
Phản ứng nào của HCl được sử dụng để sản xuất khí hydro?
Phản ứng của HCl với kim loại như Zn hoặc Fe được sử dụng để sản xuất khí hydro. -
Tại sao HCl có thể dùng để tẩy gỉ sét trên kim loại?
HCl phản ứng với gỉ sét (oxit sắt) tạo thành muối clorua tan trong nước, giúp loại bỏ gỉ sét khỏi bề mặt kim loại. -
HCl có phản ứng với tất cả các kim loại không?
Không, HCl chỉ phản ứng với các kim loại đứng trước hydro trong dãy điện hóa. -
Phản ứng của HCl với kim loại có cần điều kiện gì đặc biệt không?
Nhiệt độ có thể làm tăng tốc độ phản ứng, nhưng thường thì phản ứng xảy ra ở điều kiện thường. -
Ứng dụng nào của phản ứng HCl thể hiện tính oxi hóa là quan trọng nhất trong công nghiệp?
Sản xuất khí hydro là một trong những ứng dụng quan trọng nhất. -
Có những biện pháp an toàn nào cần lưu ý khi sử dụng HCl?
HCl là axit mạnh, cần sử dụng găng tay, kính bảo hộ và làm việc trong môi trường thông thoáng để tránh gây hại cho da và hệ hô hấp.
Tìm Hiểu Thêm Tại CAUHOI2025.EDU.VN
Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về vai trò của HCl trong các phản ứng oxi hóa – khử. Để khám phá thêm nhiều kiến thức hóa học thú vị và hữu ích khác, hãy truy cập CAUHOI2025.EDU.VN ngay hôm nay! Chúng tôi luôn sẵn sàng cung cấp cho bạn những thông tin chính xác, đáng tin cậy và dễ hiểu nhất.
Nếu bạn có bất kỳ thắc mắc nào hoặc cần tư vấn thêm, đừng ngần ngại liên hệ với chúng tôi qua địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc số điện thoại: +84 2435162967. CAUHOI2025.EDU.VN luôn đồng hành cùng bạn trên con đường chinh phục tri thức!
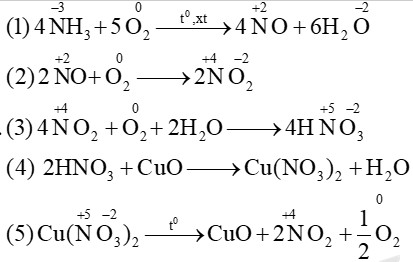
Alt: Sơ đồ phản ứng điều chế HNO3 từ NH3, thể hiện các giai đoạn oxi hóa-khử.
Hãy truy cập CauHoi2025.EDU.VN để đặt câu hỏi và nhận được sự hỗ trợ tận tình từ đội ngũ chuyên gia của chúng tôi!