Phản Ứng Khử Là Gì? Giải Thích Chi Tiết, Dễ Hiểu Nhất
Bạn đang tìm kiếm câu trả lời cho câu hỏi “Phản ứng Khử Là Gì”? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp cho bạn một định nghĩa rõ ràng, dễ hiểu về phản ứng khử, đồng thời đi sâu vào các khía cạnh liên quan như dấu hiệu nhận biết, cách lập phương trình phản ứng, các loại phản ứng oxy hóa khử và ví dụ minh họa. Chúng tôi sẽ giúp bạn nắm vững kiến thức này một cách nhanh chóng và hiệu quả.
1. Phản Ứng Khử Là Gì? Định Nghĩa Chi Tiết
Phản ứng khử là một quá trình hóa học, trong đó một nguyên tử, ion hoặc phân tử nhận electron, dẫn đến sự giảm số oxy hóa của nó. Nói một cách đơn giản, chất bị khử là chất nhận electron trong phản ứng oxy hóa – khử.
Để hiểu rõ hơn, chúng ta cần nắm vững khái niệm về số oxy hóa. Số oxy hóa là điện tích giả định của một nguyên tử trong một hợp chất nếu tất cả các liên kết là ion. Khi một chất nhận electron, số oxy hóa của nó giảm xuống, do đó nó được gọi là chất bị khử.
Ví dụ: Trong phản ứng giữa kẽm (Zn) và ion đồng (Cu2+):
Zn + Cu2+ → Zn2+ + Cu
Ion đồng (Cu2+) nhận 2 electron để trở thành đồng kim loại (Cu). Số oxy hóa của đồng giảm từ +2 xuống 0, do đó Cu2+ bị khử.
2. Dấu Hiệu Nhận Biết Phản Ứng Khử
Để nhận biết một phản ứng có phải là phản ứng khử hay không, bạn có thể dựa vào các dấu hiệu sau:
- Sự thay đổi số oxy hóa: Đây là dấu hiệu quan trọng nhất. Nếu số oxy hóa của một chất giảm sau phản ứng, chất đó đã bị khử.
- Sự nhận electron: Chất bị khử là chất nhận electron. Trong phương trình phản ứng, bạn sẽ thấy chất đó “nhận” electron từ chất khác.
- Sự mất oxy: Trong một số trường hợp, phản ứng khử có thể liên quan đến sự mất oxy của một chất. Tuy nhiên, đây không phải là dấu hiệu bắt buộc.
- Sự kết hợp với hydro: Một số phản ứng khử liên quan đến sự kết hợp của một chất với hydro.
Ví dụ minh họa:
Xét phản ứng sau:
Fe2O3 + 3CO → 2Fe + 3CO2
Trong phản ứng này:
- Sắt (Fe) trong Fe2O3 có số oxy hóa +3, sau phản ứng trở thành Fe kim loại có số oxy hóa 0. Số oxy hóa của Fe giảm, vậy Fe2O3 bị khử.
- Carbon (C) trong CO có số oxy hóa +2, sau phản ứng trở thành C trong CO2 có số oxy hóa +4. Số oxy hóa của C tăng, vậy CO bị oxy hóa.

3. Các Bước Lập Phương Trình Phản Ứng Oxy Hóa Khử
Để lập phương trình phản ứng oxy hóa khử một cách chính xác, bạn có thể thực hiện theo các bước sau:
Bước 1: Xác định số oxy hóa của các nguyên tố
Xác định số oxy hóa của tất cả các nguyên tố trong phản ứng trước và sau phản ứng. Điều này giúp bạn xác định chất nào bị oxy hóa và chất nào bị khử.
Bước 2: Viết các nửa phản ứng
Tách phản ứng thành hai nửa phản ứng: một nửa phản ứng oxy hóa (chất khử mất electron) và một nửa phản ứng khử (chất oxy hóa nhận electron).
Bước 3: Cân bằng các nửa phản ứng
- Cân bằng số lượng nguyên tử của mỗi nguyên tố trong mỗi nửa phản ứng.
- Cân bằng điện tích bằng cách thêm electron vào vế thích hợp.
Bước 4: Cân bằng số electron
Nhân mỗi nửa phản ứng với một hệ số sao cho số electron mất đi trong nửa phản ứng oxy hóa bằng số electron nhận được trong nửa phản ứng khử.
Bước 5: Cộng các nửa phản ứng
Cộng hai nửa phản ứng đã cân bằng lại với nhau. Loại bỏ các electron ở cả hai vế của phương trình.
Bước 6: Kiểm tra và tối giản
Kiểm tra xem phương trình đã cân bằng về số lượng nguyên tử và điện tích hay chưa. Tối giản phương trình nếu cần thiết.
Ví dụ: Cân bằng phản ứng sau:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
-
Xác định số oxy hóa:
- KMnO4: K(+1), Mn(+7), O(-2)
- HCl: H(+1), Cl(-1)
- KCl: K(+1), Cl(-1)
- MnCl2: Mn(+2), Cl(-1)
- Cl2: Cl(0)
- H2O: H(+1), O(-2)
-
Viết các nửa phản ứng:
- Khử: MnO4- + 5e- → Mn2+
- Oxy hóa: 2Cl- → Cl2 + 2e-
-
Cân bằng các nửa phản ứng:
- Khử: MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
- Oxy hóa: 2Cl- → Cl2 + 2e-
-
Cân bằng số electron:
- Khử: 2(MnO4- + 8H+ + 5e- → Mn2+ + 4H2O)
- Oxy hóa: 5(2Cl- → Cl2 + 2e-)
-
Cộng các nửa phản ứng:
- 2MnO4- + 16H+ + 10Cl- → 2Mn2+ + 8H2O + 5Cl2
-
Kiểm tra và tối giản:
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
4. Các Loại Phản Ứng Oxy Hóa Khử
Phản ứng oxy hóa khử có thể được phân loại thành các loại sau:
4.1. Phản ứng oxy hóa – khử thông thường
Đây là loại phản ứng mà chất khử và chất oxy hóa tồn tại ở hai phân tử khác nhau.
Ví dụ:
C + 4HNO3 (đặc) → CO2 + 4NO2 + 2H2O
Cu + 2H2SO4 (đặc) → CuSO4 + SO2 + 2H2O
4.2. Phản ứng oxy hóa – khử nội phân tử
Trong loại phản ứng này, chất khử và chất oxy hóa thuộc cùng một phân tử nhưng ở hai nguyên tử khác nhau.
Ví dụ:
AgNO3 → Ag + NO2 + O2
Cu(NO3)2 → CuO + NO2 + O2
4.3. Phản ứng tự oxy hóa – khử
Đây là loại phản ứng mà chất khử đồng thời là chất oxy hóa.
Ví dụ:
Cl2 + 2KOH → KCl + KClO + H2O
4KClO3 → 3KClO4 + KCl
5. Ví Dụ Về Phản Ứng Khử Trong Hóa Học Lớp 10
5.1. Phản ứng giữa Al và HNO3
Trong phản ứng giữa nhôm (Al) và axit nitric (HNO3), nhôm bị oxy hóa và axit nitric bị khử.
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
Số oxy hóa của Al tăng từ 0 lên +3, trong khi số oxy hóa của N trong HNO3 giảm từ +5 xuống +4 trong NO2.
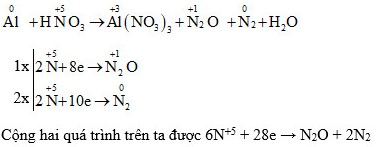
5.2. Phản ứng giữa KMnO4 và HCl
Trong phản ứng giữa kali pemanganat (KMnO4) và axit clohydric (HCl), KMnO4 đóng vai trò là chất oxy hóa và HCl đóng vai trò là chất khử.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Số oxy hóa của Mn giảm từ +7 trong KMnO4 xuống +2 trong MnCl2, trong khi số oxy hóa của Cl tăng từ -1 trong HCl lên 0 trong Cl2.

5.3. Phản ứng giữa Cu và H2SO4
Trong phản ứng giữa đồng (Cu) và axit sulfuric (H2SO4) đặc, nóng, đồng bị oxy hóa và axit sulfuric bị khử.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Số oxy hóa của Cu tăng từ 0 lên +2, trong khi số oxy hóa của S trong H2SO4 giảm từ +6 xuống +4 trong SO2.

6. Ý Nghĩa Của Phản Ứng Oxy Hóa Khử Trong Hóa Học Lớp 10
Phản ứng oxy hóa khử là một loại phản ứng cơ sở rất quan trọng trong tự nhiên và đời sống. Chúng tồn tại ở nhiều dạng như quá trình trao đổi chất trong cơ thể, sự hô hấp của con người trong tế bào và cơ thể, quá trình thực vật hấp thụ chất khí cacbonic và giải phóng ra oxy.
Ngoài ra, phản ứng này cũng xảy ra ở sự đốt cháy nhiên liệu trong các động cơ, quá trình điện phân, phản ứng trong pin và trong acquy…
Quá trình sản xuất ví dụ như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học… cũng đều có sự xuất hiện của phản ứng oxy hóa khử. Theo một nghiên cứu của Đại học Quốc gia Hà Nội, Khoa Hóa học, vào tháng 5 năm 2023, các quy trình sản xuất công nghiệp hiện đại ngày càng phụ thuộc vào việc kiểm soát và tối ưu hóa các phản ứng oxy hóa khử để tạo ra sản phẩm hiệu quả và bền vững.
7. Bài Tập Luyện Tập Về Phản Ứng Oxy Hóa Khử
7.1. Bài tập SGK cơ bản và nâng cao
Ví dụ 1: Cần bao nhiêu gam đồng để khử hoàn toàn lượng ion bạc có trong 85ml dung dịch AgNO3 0,15M?
Hướng dẫn giải:
VAgNO3 = 85 ml = 85/100 lít
⇒ Cm=n/V ⇒ n=0,15.85/1000=0,01275 mol
Phương trình phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Theo phương trình ta có:
nCu = ½ nAgNO3 = 0,01275/2 = 0,006375 mol
Vậy ta có: mCu = 0,006375 x 64 = 0,408g.
Ví dụ 2: Hòa tan 7,8g hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau quá trình phản ứng thấy khối lượng dung dịch axit tăng thêm 7,0g. Khối lượng nhôm và magie trong hỗn hợp đầu là?
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng ta có :mH2 = 7,8-7,0 =0,8 gam
Mặt khác theo công thức 1 và theo đề ta có hệ phương trình:
(Khi tham gia phản ứng thì thông thường nhôm nhường 3e, kim loại magie nhường 2e và khí H2 thường thu về 2 e)
3.nAl + 2.nMg =2.nH2=2.0.8/2 (1)
27.nAl +24.nMg =7,8 (2)
Có phương trình (1), (2) ta có như sau: nAl =0.2 mol và nMg = 0.1 mol
Từ đó ta có thể tính được mAl =27.0,2 =5,4 gam; mMg =24.0,1 =2,4 gam
Ví dụ 3: Cho 15,8 gam KmnO4 tác dụng với dung dịch HCl đậm đặc. Tính thể tích khí clo thu được ở đktc.
Hướng dẫn giải:
Ta có: Mn+7 nhường 5 e (Mn+2),Cl-thu 2.e (Cl2)
Áp dụng định luật bảo toàn e ta có được
5.nKmnO4 =2.nCl2
→ nCl2 = 5/2 nKmnO4 =0.25 mol → VCl2 =0,25 . 22,4 =0,56 lít
Ví dụ 4: Hòa tan hoàn toàn 20g hỗn hợp Mg và Fe vào dung dịch axit HCl dư thấy có 11,2 lít khí thoát ra ở đktc và dung dịch X. Đem cô cạn dung dịch X thì ta thu được khối lượng bao nhiêu gam muối khan?
Hướng dẫn giải:
Áp dụng công thức 2 ta có:
mmuối = m kim loại + mion tạo muố
i= 20 + 71.0,5=55.5g
Ví dụ 5: Hòa tan 15 gam hỗn hợp X gồm hai kim loại Mg và Al vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O. Phần trăm khối lượng của 2 nguyên tố Al và Mg trong hỗn hợp X lần lượt là:
Hướng dẫn giải:
Ta có 24 nMg + 27 nAl =15 (1)
- Xét quá trình oxi hóa:
Mg → Mg2++ 2e
Al → Al3++3e
→ Tổng số mol e nhường = 2nMg + 3 nAl
- Xét quá trình khử:
2N+5 +2.4e → 2 N+1
S+6 + 2e → S+4
→ Tổng số mol e nhận = 2.0,4 + 0,2 = 1,4 mol
Theo định luật bảo toàn e ta có:
2nMg + 3 nAl = 1,4 (2)
Giải hệ (1) và (2) ta được nMg = 0,4 mol, nAl =0,2 mol
→% Al = 27.0,2/15 = 36%
→%Mg = 64%
7.2. Bài tập trắc nghiệm về phản ứng oxy hóa khử
Bài 1: Chất khử là chất:
A. Cho được điện tích (electron), chứa các nguyên tố có số oxi hóa tăng lên sau phản ứng.
B. Cho được điện tích, chứa các nguyên tố có số oxi hóa giảm xuống sau phản ứng.
C. Nhận được điện tích, chứa các nguyên tố có số oxi hóa tăng lên sau phản ứng.
D. Nhận điện tích, chứa các nguyên tố có số oxi hóa giảm xuống sau phản ứng.
Bài 2: Chất oxi hoá là chất
A. Cho điện tích, chứa các nguyên tố có số oxi hóa tăng lên sau phản ứng.
B. Cho điện tích, chứa các nguyên tố có số oxi hóa giảm xuống sau phản ứng.
C. Nhận điện tích, chứa các nguyên tố có số oxi hóa tăng lên sau phản ứng.
D. Nhận điện tích, chứa các nguyên tố có số oxi hóa giảm xuống sau phản ứng.
Bài 3: Trong một phân tử NH4NO3 thì ta có số oxi hóa của 2 nguyên tử nitơ sẽ là:
A. +1 và +1 B. –4 và +6 C. –3 và +5 D. –3 và +6
Bài 4: Cho quá trình : Fe2+ → Fe3+ + 1e. Đây là quá trình :
A. Oxi hóa. B. Khử .
C. Nhận proton. D. Tự oxi hóa – khử.
Bài 5: Tính số mol của electron cần dùng để khử 1,5 mol Al3+ thành Al?
A. 0,5. B. 1,5.
C. 3,0. D. 4,5.
Bài 6: Trong phản ứng Zn + CuCl2 → ZnCl2 + Cu, một mol Cu2+ đã
A. Nhận 1 mol electron. B. Nhường 1 mol e.
C. Nhận 2 mol electron. D. Nhường 2 mol electron.
Bài 7: ở phản ứng sau đây, vai trò của khí H2S là là :
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
A. Chất oxi hóa. B. chất khử. C. Axit. D. Vừa oxi hóa vừa khử.
Bài 8: Phát biểu nào sau đây chưa đúng ?
A. Phản ứng oxi hoá – khử là loại phản ứng luôn xảy ra một cách đồng thời cả sự oxi hoá và sự khử.
B. Phản ứng oxi hoá – khử là loại phản ứng trong đó có xảy ra sự thay đổi số oxi hoá của tất cả các nguyên tố hóa há»c tham gia.
C. Phản ứng oxi hoá – khử là loại phản ứng trong đó có xảy ra sự trao đổi Ä‘iện tÃch electron giữa các chất tham gia.
D. Phản ứng oxi hoá – khử là loại phản ứng trong đó có xảy ra sự thay đổi số oxi hoá của má»™t hoặc má»™t số nguyên tố hóa há»c tham gia.
Bài 9: Trong các phản ứng sau đây, phản ứng nào mà nguyên tố cacbon thể hiện đồng thời cả tính oxi hoá và tính khử?
A. C + 2H2 → CH4 B. 3C + 4Al → Al4C3
C. 3C + CaO → CaC2 + CO D. C + CO2 → 2CO
Bài 10: Phản ứng giữa các nhóm chất nào dưới đây luôn được coi là phản ứng oxi hóa – khử ?
A. oxit phi kim với bazơ. B. oxit kim loại với axit.
C. kim loại với phi kim. D. oxit kim loại với oxit phi kim.
Bài 11: Trong các phản ứng dưới đây, phản ứng nào mà chất HCl thể hiện được tính oxi hoá?
A. HCl+ AgNO3 → AgCl + HNO3
B. 2HCl + Mg → MgCl2 + H2
C. 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
D. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Bài 12: Trong phản ứng sau đây, vai trò của chất HCl là gì?
MnO2 + 4HCl → MnCl2 +Cl2+ 2H2O
A. oxi hóa. B. chất khử. C. tạo môi trường. D. chất khử và môi trường.
Bài 13: Cho phản ứng: 4HNO3đặc nóng + Cu → Cu(NO3)2 + 2NO2 + 2H2O. ở phản ứng trên thì HNO3 đóng vai trò là gì?
A. chất oxi hóa. B. axit. C. môi trường. D. chất oxi hóa với môi trường.
Bài 14: Hòa tan Cu2S ở trong dung dịch axit HNO3 loãng, nóng, dư. Sản phẩm sau phản ứng thu được là :
A. Cu(NO3)2 + CuSO4 + H2O. B. Cu(NO3)2 + H2SO4 + NO + H2O.
C. Cu(NO3)2 + H2SO4 + H2O. D. Cu(NO3)2 + CuSO4 + NO2 + H2O.
Bài 15: Phản ứng nhiệt phân muối thuộc nhóm phản ứng nào?
A. oxi hóa – khử. B. không oxi hóa – khử.
C. oxi hóa – khử hoặc không. D. thuáºn nghịch.
Bài 16: Cho các phản ứng sau đây:
Ca(OH)2 + Cl2 → CaOCl2 + H2O
2H2S + SO2 → 3S + 2H2O
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4KClO3 → KCl + 3KClO4.
Số lượng phản ứng oxi hóa – khử là :
A. 1 B. 2 C. 3 D. 4.
Bài 17: Loại phản ứng hoá há»c nà o dÆ°á»›i đây luôn được coi là phản ứng oxi hóa-khử ?
A. Phản ứng hoá hợp B. Phản ứng phân huá»·
C . Phản ứng thế D. Phản ứng trung hoÃ
Bài 18: Tổng hệ số cân bằng phương trình của các chất ở trong phản ứng sau đây là :
Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
A. 55. B. 20. C. 25. D. 50.
Bài 19: Hãy cho biết những cặp khái niệm nào sau đây là tương đương nhau?
A. quá trình oxi hóa với sự oxi hóa. B. quá trình oxi hóa với chất oxi hóa.
C. quá trình khử với sự oxi hóa. D. quá trình oxi hóa với chất khử.
Bài 20: Khi tham gia và o các phản ứng hoá há»c, các nguyên tá» kim loại sẽ:
A. bị khá». B. bị oxi hoá. C. cho proton. D. nháºn proton.
Đáp án tham khảo:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|
| A | D | C | A | D | C | B | B | C | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | D | D | B | C | D | C | A | A | B |
8. FAQ – Câu Hỏi Thường Gặp Về Phản Ứng Khử
-
Phản ứng khử có nhất thiết phải có oxy tham gia không?
- Không, phản ứng khử là quá trình nhận electron, không nhất thiết phải liên quan đến oxy.
-
Chất khử là gì?
- Chất khử là chất nhường electron trong phản ứng oxy hóa – khử, làm tăng số oxy hóa của chính nó.
-
Làm thế nào để xác định chất bị khử trong một phản ứng?
- Xác định số oxy hóa của các chất trước và sau phản ứng. Chất nào có số oxy hóa giảm là chất bị khử.
-
Phản ứng oxy hóa và phản ứng khử có thể xảy ra độc lập không?
- Không, phản ứng oxy hóa và phản ứng khử luôn đi kèm với nhau. Nếu có một chất bị oxy hóa, phải có một chất khác bị khử.
-
Tại sao cần cân bằng phương trình phản ứng oxy hóa khử?
- Để đảm bảo tuân thủ định luật bảo toàn khối lượng và điện tích.
-
Phản ứng oxy hóa khử có ứng dụng gì trong thực tế?
- Rất nhiều, từ sản xuất công nghiệp, luyện kim, điện phân, đến các quá trình sinh học trong cơ thể.
-
Phản ứng tự oxy hóa khử là gì?
- Là phản ứng mà một chất vừa đóng vai trò là chất oxy hóa, vừa đóng vai trò là chất khử.
-
Số oxy hóa là gì?
- Là điện tích giả định của một nguyên tử trong một hợp chất nếu tất cả các liên kết là ion.
-
Làm thế nào để xác định số oxy hóa của một nguyên tố trong hợp chất?
- Tuân theo các quy tắc xác định số oxy hóa (ví dụ: số oxy hóa của oxy thường là -2, hydro thường là +1).
-
Có những phương pháp nào để cân bằng phản ứng oxy hóa khử?
- Phương pháp thăng bằng electron và phương pháp ion-electron.
Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về phản ứng khử. Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại truy cập CAUHOI2025.EDU.VN để tìm kiếm câu trả lời hoặc liên hệ với chúng tôi để được tư vấn chi tiết hơn. Chúng tôi luôn sẵn lòng hỗ trợ bạn trên con đường chinh phục kiến thức!
Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
Số điện thoại: +84 2435162967
Trang web: CauHoi2025.EDU.VN