HNO3 Thể Hiện Tính Axit Mạnh Khi Tác Dụng Với Những Chất Nào?
Bạn đang tìm hiểu về tính chất hóa học của axit nitric (HNO3) và muốn biết Hno3 Thể Hiện Tính Axit Mạnh Khi Tác Dụng Với những chất nào? Bài viết này của CAUHOI2025.EDU.VN sẽ cung cấp thông tin chi tiết, dễ hiểu về khả năng phản ứng của HNO3, giúp bạn nắm vững kiến thức và ứng dụng hiệu quả. Hãy cùng khám phá!
1. Axit Nitric (HNO3) Là Gì?
Axit nitric, với công thức hóa học HNO3, là một hợp chất vô cơ quan trọng, được biết đến với nhiều tên gọi khác như acid nitric hay dung dịch nitrat hidro. HNO3 là một axit mạnh, có tính ăn mòn cao và đóng vai trò quan trọng trong nhiều ngành công nghiệp khác nhau.
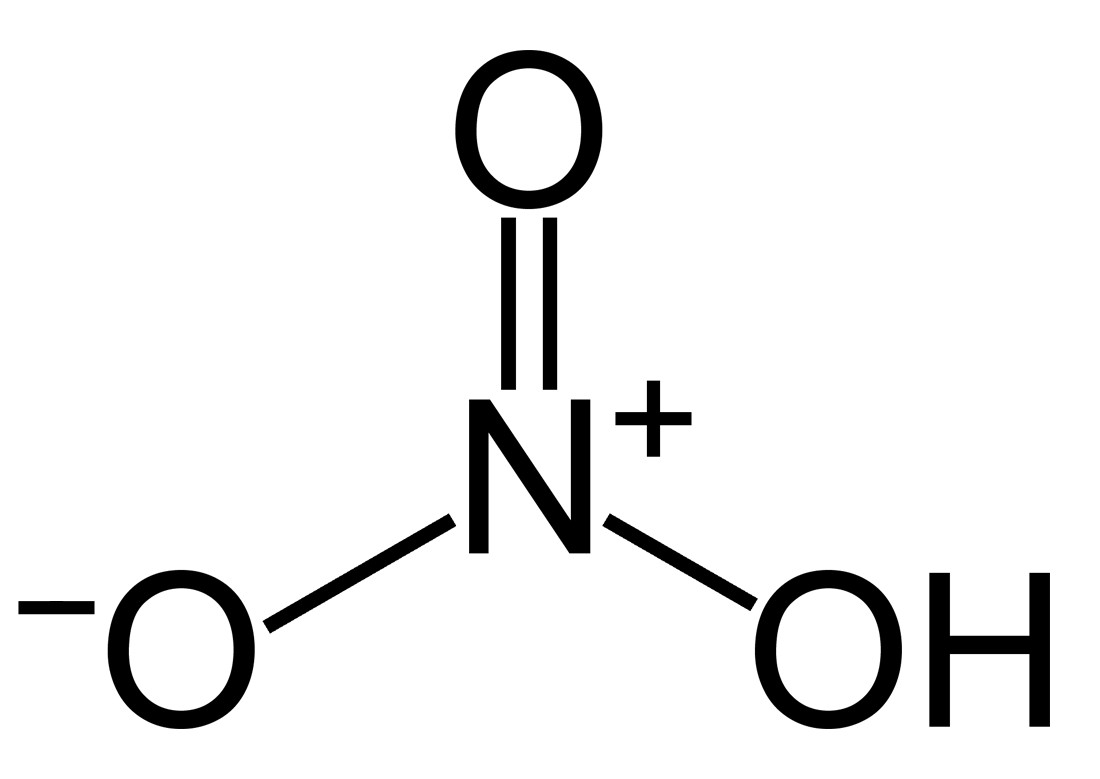
2. Cấu Tạo Phân Tử Axit Nitric (HNO3)
Phân tử axit nitric bao gồm một nguyên tử hydro (H), một nguyên tử nitơ (N) và ba nguyên tử oxy (O). Nguyên tử nitơ liên kết với một nhóm hydroxyl (-OH) và hai nguyên tử oxy khác. Cấu trúc này tạo nên tính axit mạnh và khả năng oxy hóa đặc trưng của HNO3.
3. Tính Chất Vật Lý Nổi Bật Của Axit Nitric
- Trạng thái: Tồn tại ở dạng lỏng hoặc khí, không màu.
- Độ tan: Tan hoàn toàn trong nước.
- Màu sắc: Axit nitric trong tự nhiên có thể có màu vàng nhạt do tích tụ oxit nitơ.
- Tính chất ăn mòn: Có tính ăn mòn cao, dễ bắt lửa và cực độc.
- Khói trắng: Axit nitric nồng độ 86% bốc khói trắng trong không khí.
- Nhiệt độ đông đặc: -41°C.
- Nhiệt độ sôi: 83°C.
- Phân hủy: Dưới ánh sáng, HNO3 phân hủy thành nitơ đioxit (NO2), nước (H2O) và oxy (O2). Do đó, cần bảo quản trong chai lọ tối màu, tránh ánh sáng và nhiệt độ dưới 0°C.
4. HNO3 Thể Hiện Tính Axit Mạnh Khi Tác Dụng Với? Tính Chất Hóa Học Đặc Trưng
HNO3 là một axit mạnh, thể hiện đầy đủ tính chất của một axit thông thường, đồng thời có tính oxy hóa mạnh. Dưới đây là các phản ứng tiêu biểu thể hiện tính axit mạnh của HNO3:
4.1. Tác Dụng Với Bazơ, Oxit Bazơ, Muối Cacbonat
HNO3 phản ứng với bazơ, oxit bazơ và muối cacbonat tạo thành muối nitrat, nước và (trong trường hợp muối cacbonat) khí CO2.
-
Với oxit bazơ:
2HNO3 + CuO → Cu(NO3)2 + H2O -
Với bazơ:
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O -
Với muối cacbonat:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
4.2. Tác Dụng Với Kim Loại
HNO3 tác dụng với hầu hết các kim loại (trừ Au và Pt) tạo thành muối nitrat, nước và các sản phẩm khử khác (tùy thuộc vào nồng độ axit và hoạt động của kim loại).
-
Với HNO3 đặc, nóng:
Kim loại + HNO3 đặc → muối nitrat + NO2 + H2O -
Với HNO3 loãng:
Kim loại + HNO3 loãng → muối nitrat + NO + H2O -
Với HNO3 loãng, lạnh:
Kim loại + HNO3 loãng, lạnh → muối nitrat + H2Ví dụ:
Mg(rắn) + 2HNO3 loãng, lạnh → Mg(NO3)2 + H2 (khí)Lưu ý: Nhôm (Al), sắt (Fe), crom (Cr) bị thụ động hóa bởi HNO3 đặc, nguội do lớp oxit kim loại bảo vệ.
4.3. Tác Dụng Với Phi Kim
HNO3 tác dụng với nhiều phi kim (trừ silic và halogen) tạo thành nitơ đioxit (nếu là HNO3 đặc) hoặc oxit nitơ (với HNO3 loãng), nước và oxit của phi kim.
-
Với HNO3 đặc:
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2 P + 5HNO3 đặc → 5NO2 + H2O + H3PO4 -
Với HNO3 loãng:
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
4.4. Tác Dụng Với Oxit Bazơ, Bazơ, Muối Của Kim Loại Chưa Đạt Hóa Trị Cao Nhất
HNO3 oxy hóa các kim loại trong hợp chất lên hóa trị cao nhất.
-
Ví dụ:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
4.5. Tác Dụng Với Hợp Chất
-
Ví dụ:
3H2S + 2HNO3 (>5%) → 3S (kết tủa) + 2NO + 4H2O PbS + 8HNO3 đặc → PbSO4 (kết tủa) + 8NO2 + 4H2OAg3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
4.6. Tác Dụng Với Hợp Chất Hữu Cơ
HNO3 có khả năng phá hủy nhiều hợp chất hữu cơ, gây nguy hiểm nếu tiếp xúc với cơ thể người. Do đó, cần hết sức cẩn trọng khi làm việc với HNO3.

5. Điều Chế Axit Nitric (HNO3)
5.1. Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, HNO3 được điều chế bằng cách cho muối natri nitrat (NaNO3) tác dụng với axit sunfuric (H2SO4) đặc, sau đó chưng cất hỗn hợp ở nhiệt độ sôi của HNO3 (83°C).
H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4Phương pháp này chỉ tạo ra một lượng nhỏ axit.
5.2. Trong Công Nghiệp
Trong công nghiệp, HNO3 được sản xuất bằng quy trình Ostwald, bao gồm các giai đoạn:
-
Oxy hóa amoniac: Oxy hóa amoniac (NH3) bằng oxy (O2) với xúc tác platin (Pt) ở nhiệt độ cao (850°C) để tạo thành nitơ monoxit (NO) và nước (H2O).
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC) -
Oxy hóa nitơ monoxit: Oxy hóa NO thành nitơ đioxit (NO2).
2NO + O2 → 2NO2 -
Hấp thụ nitơ đioxit: Hấp thụ NO2 bằng nước và oxy để tạo thành axit nitric (HNO3).
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit nitric công nghiệp thường có nồng độ 52% hoặc 68%. Để thu được axit có nồng độ cao hơn, cần chưng cất với axit sunfuric (H2SO4) đặc để loại bỏ nước.
6. Ứng Dụng Rộng Rãi Của Axit Nitric (HNO3) Trong Thực Tiễn
Axit nitric có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
6.1. Trong Phòng Thí Nghiệm
- Sử dụng làm thuốc thử để phát hiện clorua.
- Điều chế muối nitrat.
6.2. Trong Công Nghiệp
- Sản xuất thuốc nổ: Trinitrotoluen (TNT), nitroglycerin, cyclotrimethylenetrinitramine (RDX).
- Sản xuất phân bón: Phân đạm (NH4NO3), muối nitrat (Ca(NO3)2, KNO3).
- Phân tích kim loại: Xác định kim loại trong dung dịch bằng kỹ thuật ICP-AES và ICP-MS (cần HNO3 tinh khiết).
- Luyện kim, tinh luyện, xi mạ: Làm sạch và xử lý bề mặt kim loại.
- Sản xuất chất hữu cơ, sơn, bột màu, thuốc nhuộm vải.
- Sản xuất nitrobenzen: Tiền chất để sản xuất anilin, sợi aramit, bọt xốp polyuretan và dược phẩm.
- Sản xuất chất kết dính, chất bọc phủ, chất bịt kín và chất đàn hồi từ toluen diisoxyanat.
- Trong nhà máy sữa: Tẩy rửa đường ống, bề mặt kim loại.
- Xử lý nước: Loại bỏ tạp chất và cân bằng độ tiêu chuẩn của nước.
- Nhiên liệu lỏng tên lửa: Chất oxy hóa.
- Tẩy rửa và khử trùng: Trong nhiều ngành công nghiệp khác nhau.

7. Lưu Ý Quan Trọng Khi Sử Dụng Axit Nitric
Axit nitric là một hóa chất nguy hiểm, cần tuân thủ các biện pháp an toàn sau:
- Bảo hộ cá nhân: Đeo kính bảo hộ, găng tay, áo choàng và mặt nạ phòng độc khi làm việc với HNO3.
- Thông gió: Làm việc trong khu vực thông gió tốt.
- Tránh tiếp xúc: Tránh để HNO3 tiếp xúc với da, mắt và đường hô hấp.
- Xử lý sự cố: Nếu bị HNO3 bắn vào da hoặc mắt, rửa ngay lập tức bằng nhiều nước và đến cơ sở y tế gần nhất.
- Bảo quản: Bảo quản HNO3 trong chai lọ tối màu, đậy kín, ở nơi khô ráo, thoáng mát, tránh ánh sáng trực tiếp và xa các chất dễ cháy, chất khử.
- Không pha loãng: Không pha loãng HNO3 bằng nước trong bình kín vì có thể gây nổ.
- Xử lý chất thải: Xử lý chất thải HNO3 theo quy định của pháp luật về hóa chất nguy hiểm.
8. Mua Axit Nitric (HNO3) Ở Đâu Uy Tín Tại Việt Nam?
Bạn đang tìm kiếm địa chỉ mua axit nitric uy tín, chất lượng tại Hà Nội và TP. Hồ Chí Minh? CAUHOI2025.EDU.VN gợi ý bạn nên lựa chọn các công ty chuyên cung cấp hóa chất công nghiệp uy tín, có đầy đủ giấy phép kinh doanh và chứng nhận chất lượng sản phẩm.
Một trong những đơn vị hàng đầu trong lĩnh vực này là VIETCHEM. Với nhiều năm kinh nghiệm, VIETCHEM cam kết cung cấp các sản phẩm hóa chất chính hãng, chất lượng cao, đáp ứng mọi nhu cầu của khách hàng.
Nếu bạn đang băn khoăn và không biết nên mua axit nitric ở đâu để đảm bảo chất lượng, hãy nhấc máy lên và gọi tới số hotline 0826 010 010 của VIETCHEM để được tư vấn và báo giá tốt nhất.
Địa chỉ liên hệ của VietChem: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
9. Câu Hỏi Thường Gặp (FAQ) Về Axit Nitric (HNO3)
Dưới đây là một số câu hỏi thường gặp về axit nitric:
- HNO3 có ăn mòn không?
- Có, HNO3 là một axit mạnh và có tính ăn mòn cao.
- HNO3 tác dụng với kim loại nào?
- HNO3 tác dụng với hầu hết các kim loại trừ vàng (Au) và bạch kim (Pt).
- HNO3 đặc nguội có tác dụng với kim loại không?
- HNO3 đặc nguội không tác dụng với nhôm (Al), sắt (Fe), crom (Cr) do hiện tượng thụ động hóa.
- HNO3 được điều chế như thế nào trong công nghiệp?
- HNO3 được điều chế trong công nghiệp bằng quy trình Ostwald.
- Ứng dụng chính của HNO3 là gì?
- HNO3 được sử dụng rộng rãi trong sản xuất phân bón, thuốc nổ, chất dẻo và nhiều ngành công nghiệp khác.
- HNO3 có độc không?
- Có, HNO3 là một chất độc và có thể gây bỏng nếu tiếp xúc với da.
- Làm thế nào để bảo quản HNO3 an toàn?
- Bảo quản HNO3 trong chai lọ tối màu, đậy kín, ở nơi khô ráo, thoáng mát, tránh ánh sáng trực tiếp.
- HNO3 có tác dụng với chất hữu cơ không?
- Có, HNO3 có thể phá hủy nhiều hợp chất hữu cơ.
- HNO3 có màu gì?
- HNO3 tinh khiết không màu, nhưng có thể có màu vàng nhạt do lẫn tạp chất.
- HNO3 có nguy hiểm không?
- Có, HNO3 là một chất nguy hiểm và cần được sử dụng cẩn thận.
Lời Kết
Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về tính chất và ứng dụng của axit nitric. Để tìm hiểu thêm về các hợp chất hóa học khác và được giải đáp mọi thắc mắc, hãy truy cập CauHoi2025.EDU.VN ngay hôm nay! Đừng ngần ngại đặt câu hỏi của bạn để nhận được sự tư vấn tận tình từ đội ngũ chuyên gia của chúng tôi.


