Fe Hóa Trị Mấy? Khi Nào Fe Có Hóa Trị II và III?
Bạn đang thắc mắc về hóa trị của sắt (Fe) trong hóa học? CAUHOI2025.EDU.VN sẽ giúp bạn hiểu rõ về Hóa Trị Của Fe, từ cấu hình electron đến các phản ứng hóa học cụ thể, giúp bạn nắm vững kiến thức hóa học một cách dễ dàng. Khám phá ngay để giải đáp mọi thắc mắc về hóa trị của sắt và ứng dụng của nó!
1. Fe Hóa Trị Mấy Trong Hóa Học?
Sắt (Fe) là một nguyên tố kim loại chuyển tiếp quan trọng, có khả năng thể hiện nhiều hóa trị khác nhau trong các hợp chất hóa học. Tuy nhiên, hai hóa trị phổ biến nhất của sắt là +2 và +3.

Hóa trị của sắt phụ thuộc vào điều kiện phản ứng và các nguyên tố khác mà nó liên kết. Để hiểu rõ hơn, chúng ta cần xem xét cấu hình electron của sắt và cách nó tham gia vào các liên kết hóa học.
1.1. Tại Sao Sắt Có Hai Hóa Trị?
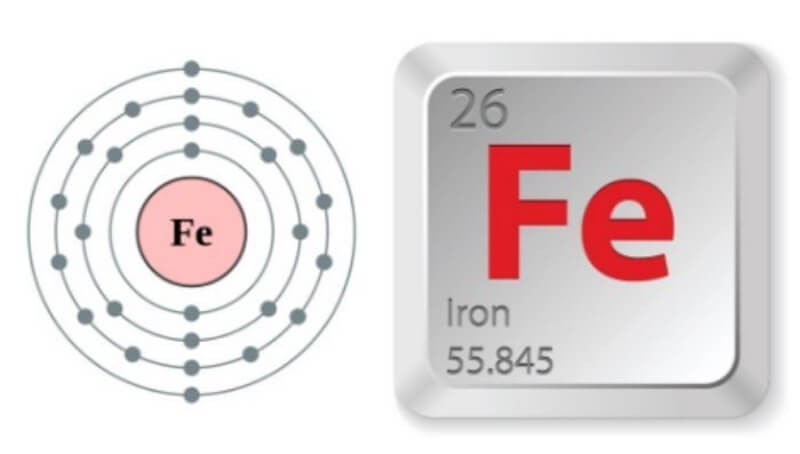
Để giải thích tại sao sắt có thể thể hiện hai hóa trị phổ biến là +2 và +3, chúng ta cần xem xét cấu hình electron của nó. Theo một nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội, cấu hình electron quyết định khả năng tạo liên kết và hóa trị của một nguyên tố.
- Số hiệu nguyên tử của Fe là 26.
- Cấu hình electron đầy đủ: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s².
- Viết gọn: [Ar] 3d⁶ 4s².
Sắt thuộc chu kỳ 4, nhóm VIIIB trong bảng tuần hoàn các nguyên tố hóa học.
Hóa trị của một nguyên tố là số lượng electron mà nguyên tố đó có thể mất, nhận hoặc chia sẻ để đạt được cấu hình electron bền vững, thường là cấu hình của khí hiếm. Sắt có thể thể hiện hai trạng thái hóa trị +2 và +3 do sự sắp xếp electron đặc biệt ở lớp ngoài cùng của nó.
- Khi sắt mất 2 electron ở lớp 4s, nó trở thành ion Fe²⁺ và có hóa trị +2.
- Trong một số trường hợp, sắt cũng có thể mất thêm một electron ở lớp 3d (một trong các electron đã ghép cặp), tạo thành ion Fe³⁺ và có hóa trị +3.
1.2. Ví Dụ Về Các Hợp Chất Của Sắt Theo Hóa Trị
Dưới đây là một số ví dụ về các hợp chất của sắt, minh họa cho hai hóa trị phổ biến của nó:
- Hóa trị +2:
- FeO (oxit sắt(II))
- FeSO₄ (sunfat sắt(II))
- Fe(OH)₂ (hiđroxit sắt(II))
- Hóa trị +3:
- Fe₂O₃ (oxit sắt(III))
- Fe₂(SO₄)₃ (sunfat sắt(III))
- Fe(OH)₃ (hiđroxit sắt(III))
Sự linh hoạt trong việc thay đổi hóa trị giữa +2 và +3 cho phép sắt tham gia vào nhiều phản ứng hóa học và tạo thành các hợp chất quan trọng trong cả hóa học và công nghiệp.
2. Khi Nào Fe Có Hóa Trị II và Khi Nào Có Hóa Trị III?
Để hiểu rõ hơn về hóa trị của sắt trong các phản ứng hóa học, chúng ta cần phân tích chi tiết các điều kiện và tác nhân ảnh hưởng đến sự hình thành của các hợp chất sắt(II) và sắt(III).

2.1. Khi Nào Fe Có Hóa Trị II?
Sắt thể hiện hóa trị II trong các trường hợp sau:
- Tác dụng với axit trung bình (ví dụ: HCl, H₂SO₄ loãng), là những axit mà gốc axit không có tính oxi hóa mạnh.
- Phản ứng với dung dịch muối của kim loại yếu hơn (ví dụ: muối đồng, muối chì hoặc muối sắt(III)).
- Tác dụng với phi kim có hoạt động trung bình yếu.
2.1.1. Tác Dụng Với Axit Trung Bình
Khi sắt tác dụng với các axit như HCl hoặc H₂SO₄ loãng, nó sẽ tạo thành muối sắt(II) và giải phóng khí hidro.
- Fe + H₂SO₄ (loãng) → FeSO₄ + H₂
- Fe + 2HCl → FeCl₂ + H₂
2.1.2. Tác Dụng Với Dung Dịch Muối Của Kim Loại Yếu Hơn
Sắt có thể đẩy các kim loại yếu hơn ra khỏi dung dịch muối của chúng, tạo thành muối sắt(II).
- Fe + Cu(NO₃)₂ → Fe(NO₃)₂ + Cu
- Fe + 2FeCl₃ → 3FeCl₂
2.1.3. Tác Dụng Với Phi Kim Hoạt Động Trung Bình Yếu
Sắt cũng có thể tác dụng với các phi kim như lưu huỳnh (S) để tạo thành hợp chất sắt(II).
- Fe + S → FeS
2.2. Khi Nào Fe Có Hóa Trị III?
Sắt thể hiện hóa trị III trong các trường hợp sau:
- Phản ứng với axit có tính oxi hóa mạnh (ví dụ: HNO₃, H₂SO₄ đặc, nóng).
- Tác dụng với phi kim mạnh (ví dụ: F₂, Cl₂).
- Hợp chất sắt(II) bị oxi hóa bởi chất oxi hóa mạnh, chuyển thành hợp chất sắt(III).
2.2.1. Tác Dụng Với Axit Có Tính Oxi Hóa Mạnh
Khi sắt tác dụng với các axit có tính oxi hóa mạnh như HNO₃ hoặc H₂SO₄ đặc, nóng, nó sẽ tạo thành muối sắt(III) và các sản phẩm khử khác.
- 2Fe + 6H₂SO₄ (đặc, nóng) → Fe₂(SO₄)₃ + 6H₂O + 3SO₂
2.2.2. Tác Dụng Với Phi Kim Mạnh
Sắt có thể tác dụng với các phi kim mạnh như clo (Cl₂) để tạo thành hợp chất sắt(III).
- 2Fe + 3Cl₂ → 2FeCl₃
2.2.3. Hợp Chất Sắt(II) Bị Oxi Hóa Thành Sắt(III)
Các hợp chất sắt(II) có thể bị oxi hóa thành sắt(III) bởi các chất oxi hóa mạnh.
- 2FeCl₂ + Cl₂ → 2FeCl₃
- 4FeO + O₂ → 2Fe₂O₃
3. Các Yếu Tố Ảnh Hưởng Đến Hóa Trị Của Sắt
Ngoài các điều kiện phản ứng và tác nhân oxi hóa khử, còn có một số yếu tố khác có thể ảnh hưởng đến hóa trị của sắt trong các hợp chất.
3.1. Ảnh Hưởng Của Môi Trường Phản Ứng
Môi trường phản ứng, bao gồm độ pH, nhiệt độ và sự có mặt của các ion khác, có thể ảnh hưởng đến sự ổn định của các hợp chất sắt(II) và sắt(III). Theo một nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, độ pH thấp thường ổn định hóa các hợp chất sắt(II), trong khi độ pH cao có thể thúc đẩy quá trình oxi hóa sắt(II) thành sắt(III).
3.2. Ảnh Hưởng Của Ligand
Trong các phức chất, các ligand (ion hoặc phân tử liên kết với ion kim loại trung tâm) có thể ảnh hưởng đến hóa trị và tính chất của sắt. Một số ligand có khả năng ổn định hóa sắt(II), trong khi các ligand khác lại ổn định hóa sắt(III).
Ví dụ, các ligand như xyanua (CN⁻) có xu hướng ổn định hóa sắt(II), trong khi các ligand như florua (F⁻) có xu hướng ổn định hóa sắt(III).
3.3. Ảnh Hưởng Của Cấu Trúc Tinh Thể
Trong các hợp chất rắn, cấu trúc tinh thể có thể ảnh hưởng đến hóa trị của sắt. Ví dụ, trong một số khoáng vật, sắt có thể tồn tại ở cả hai trạng thái hóa trị +2 và +3 trong cùng một cấu trúc tinh thể.
4. Ứng Dụng Của Các Hợp Chất Sắt Trong Đời Sống và Công Nghiệp
Các hợp chất của sắt đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp. Dưới đây là một số ví dụ:
4.1. Trong Y Học
Sắt là một thành phần thiết yếu của hemoglobin, protein vận chuyển oxy trong máu. Thiếu sắt có thể dẫn đến thiếu máu, một tình trạng phổ biến ảnh hưởng đến hàng triệu người trên thế giới. Các hợp chất sắt được sử dụng để điều trị và ngăn ngừa thiếu máu do thiếu sắt.
4.2. Trong Nông Nghiệp
Sắt là một vi chất dinh dưỡng cần thiết cho sự phát triển của cây trồng. Thiếu sắt có thể gây ra các triệu chứng như vàng lá và giảm năng suất. Các hợp chất sắt được sử dụng làm phân bón để bổ sung sắt cho đất và cải thiện sức khỏe của cây trồng.
4.3. Trong Xử Lý Nước
Các hợp chất sắt được sử dụng trong xử lý nước để loại bỏ các chất ô nhiễm như asen và photphat. Sắt(III) clorua (FeCl₃) là một chất keo tụ phổ biến được sử dụng để loại bỏ các hạt lơ lửng và các chất hữu cơ trong nước.
4.4. Trong Sản Xuất Vật Liệu
Sắt là thành phần chính của thép, một vật liệu xây dựng quan trọng được sử dụng trong nhiều ứng dụng khác nhau, từ xây dựng nhà cửa đến sản xuất ô tô. Các hợp chất sắt cũng được sử dụng trong sản xuất nam châm, chất xúc tác và các vật liệu khác.
5. Câu Hỏi Thường Gặp (FAQ) Về Hóa Trị Của Sắt
Dưới đây là một số câu hỏi thường gặp liên quan đến hóa trị của sắt:
- Sắt có thể có hóa trị khác ngoài +2 và +3 không?
Có, sắt có thể có các hóa trị khác, nhưng chúng ít phổ biến hơn. Ví dụ, sắt có thể có hóa trị +4 trong một số phức chất. - Làm thế nào để phân biệt giữa hợp chất sắt(II) và sắt(III)?
Có thể phân biệt bằng màu sắc, tính chất hóa học và các phản ứng đặc trưng. Ví dụ, dung dịch sắt(II) thường có màu xanh lục nhạt, trong khi dung dịch sắt(III) thường có màu vàng hoặc nâu. - Hợp chất sắt(II) có bền trong không khí không?
Không, hợp chất sắt(II) dễ bị oxi hóa thành sắt(III) trong không khí, đặc biệt là trong môi trường ẩm ướt. - Sắt có tác dụng với nước không?
Sắt không tác dụng với nước ở nhiệt độ thường. Tuy nhiên, ở nhiệt độ cao, sắt có thể phản ứng với hơi nước để tạo thành oxit sắt và hidro. - Sắt có độc không?
Các hợp chất sắt có thể độc nếu tiêu thụ với số lượng lớn. Tuy nhiên, sắt là một nguyên tố vi lượng cần thiết cho cơ thể, và việc thiếu sắt có thể gây ra các vấn đề sức khỏe nghiêm trọng. - Làm thế nào để bảo quản các hợp chất sắt(II)?
Để bảo quản các hợp chất sắt(II), cần tránh tiếp xúc với không khí và ánh sáng. Có thể thêm một lượng nhỏ axit hoặc chất khử để ngăn chặn quá trình oxi hóa. - Sắt có vai trò gì trong cơ thể người?
Sắt là thành phần quan trọng của hemoglobin, myoglobin và nhiều enzyme khác. Nó tham gia vào quá trình vận chuyển oxy, lưu trữ oxy và các phản ứng oxi hóa khử trong cơ thể. - Thiếu sắt có thể gây ra những bệnh gì?
Thiếu sắt có thể gây ra thiếu máu do thiếu sắt, mệt mỏi, suy giảm trí nhớ, giảm khả năng miễn dịch và các vấn đề sức khỏe khác. - Có những loại thực phẩm nào giàu sắt?
Các loại thực phẩm giàu sắt bao gồm thịt đỏ, gan, trứng, rau xanh đậm, đậu và ngũ cốc nguyên hạt. - Làm thế nào để tăng cường hấp thụ sắt từ thực phẩm?
Có thể tăng cường hấp thụ sắt bằng cách ăn các loại thực phẩm giàu vitamin C cùng với thực phẩm giàu sắt, tránh uống trà hoặc cà phê cùng bữa ăn, và sử dụng các sản phẩm bổ sung sắt theo chỉ định của bác sĩ.
6. Tìm Hiểu Thêm Về Hóa Học Tại CAUHOI2025.EDU.VN
Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về hóa trị của sắt (Fe) và các ứng dụng của nó. Nếu bạn còn bất kỳ thắc mắc nào hoặc muốn tìm hiểu thêm về các chủ đề hóa học khác, hãy truy cập CAUHOI2025.EDU.VN để khám phá thêm nhiều kiến thức hữu ích.
Tại CAUHOI2025.EDU.VN, bạn sẽ tìm thấy:
- Các bài viết chi tiết và dễ hiểu về nhiều chủ đề hóa học khác nhau.
- Giải đáp thắc mắc từ các chuyên gia và giảng viên hàng đầu.
- Cập nhật thông tin mới nhất về các nghiên cứu và ứng dụng trong lĩnh vực hóa học.
Đừng ngần ngại liên hệ với CAUHOI2025.EDU.VN qua địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc số điện thoại +84 2435162967 để được tư vấn và hỗ trợ tốt nhất.
Hãy để CauHoi2025.EDU.VN đồng hành cùng bạn trên con đường chinh phục kiến thức hóa học!

