Phản Ứng Khử Tăng O Giảm Là Gì? Cách Xác Định & Ứng Dụng
Bạn đang tìm hiểu về phản ứng oxi hóa khử và muốn nắm vững quy tắc “Khử Tăng O Giảm”? Bài viết này của CAUHOI2025.EDU.VN sẽ giải thích chi tiết về khái niệm này, cách xác định chất khử, chất oxi hóa, cùng các ví dụ minh họa dễ hiểu. Đừng bỏ lỡ để làm chủ kiến thức hóa học quan trọng này!
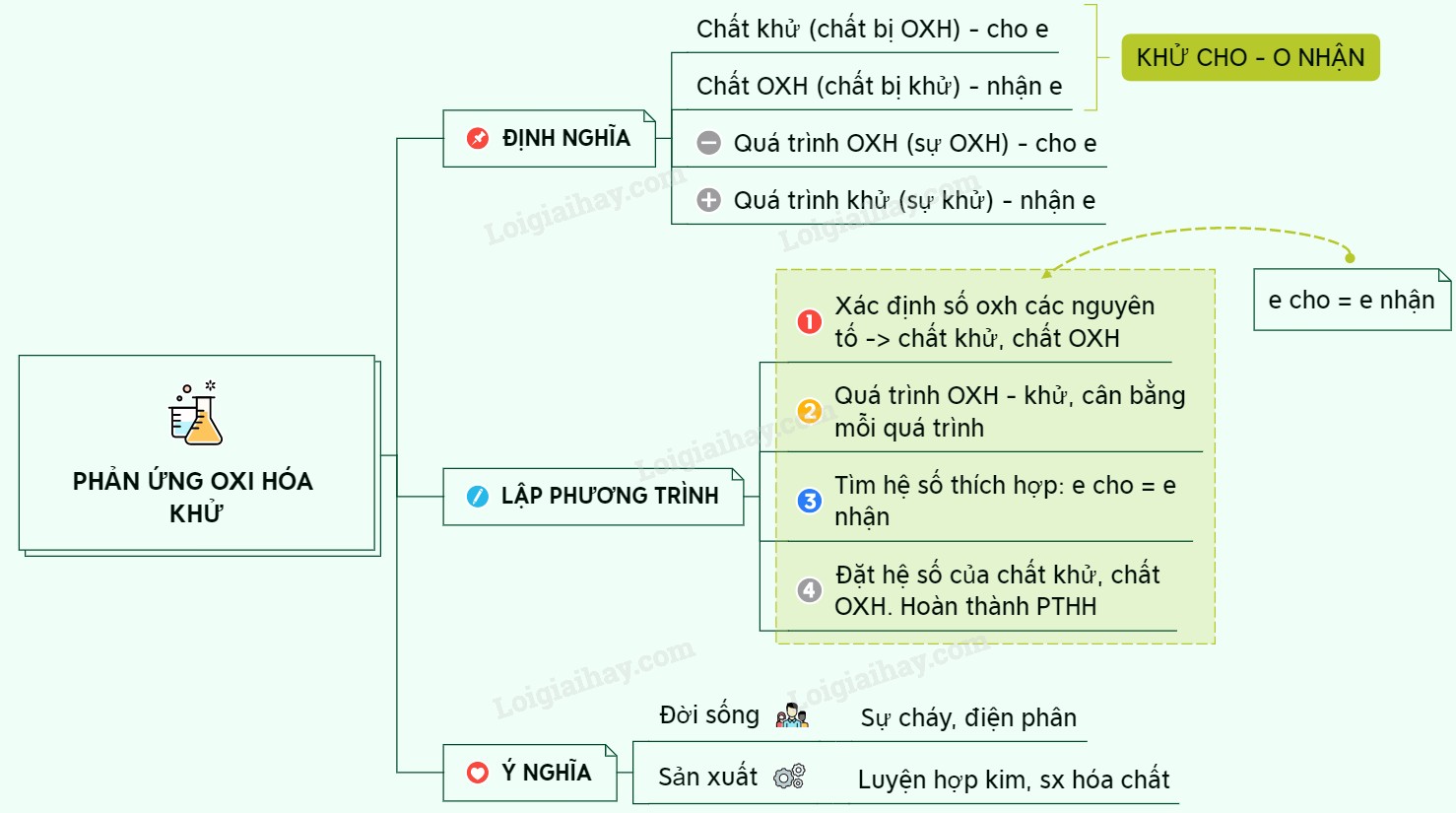
1. Phản Ứng Oxi Hóa – Khử: Tổng Quan
Phản ứng oxi hóa – khử là một loại phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một số nguyên tố. Nói cách khác, đây là phản ứng có sự chuyển electron giữa các chất tham gia. Bản chất của phản ứng là sự cho và nhận electron.
- Định nghĩa: Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
- Bản chất: Sự chuyển electron giữa các chất phản ứng.
2. Số Oxi Hóa: Khái Niệm và Quy Tắc Xác Định
Số oxi hóa là điện tích hình thức của một nguyên tử trong một hợp chất, giả định rằng tất cả các liên kết đều là liên kết ion. Việc xác định đúng số oxi hóa là chìa khóa để nhận biết và cân bằng các phản ứng oxi hóa – khử.
2.1. Quy Tắc Xác Định Số Oxi Hóa
Để xác định số oxi hóa, chúng ta tuân theo các quy tắc sau:
- Nguyên tố tự do: Số oxi hóa bằng 0. Ví dụ: Na, Cu, O2, N2, Fe.
- Ion đơn nguyên tử: Số oxi hóa bằng điện tích của ion. Ví dụ: Na+ có số oxi hóa +1, Cl- có số oxi hóa -1.
- Hydro (H): Thường có số oxi hóa +1 (trừ trong các hydride kim loại như NaH, CaH2, số oxi hóa là -1).
- Oxy (O): Thường có số oxi hóa -2 (trừ trong OF2 là +2, hoặc peroxide như H2O2 là -1).
- Kim loại kiềm (nhóm IA): Luôn có số oxi hóa +1 trong hợp chất.
- Kim loại kiềm thổ (nhóm IIA): Luôn có số oxi hóa +2 trong hợp chất.
- Tổng số oxi hóa: Trong một phân tử trung hòa, tổng số oxi hóa của tất cả các nguyên tử bằng 0. Trong một ion đa nguyên tử, tổng số oxi hóa bằng điện tích của ion.
2.2. Ví Dụ Minh Họa
-
Xác định số oxi hóa của Mn trong KMnO4:
- K có số oxi hóa +1, O có số oxi hóa -2.
- Tổng số oxi hóa: (+1) + Mn + 4(-2) = 0
- => Mn = +7
-
Xác định số oxi hóa của Cr trong K2Cr2O7:
- K có số oxi hóa +1, O có số oxi hóa -2.
- Tổng số oxi hóa: 2(+1) + 2Cr + 7(-2) = 0
- => Cr = +6
3. Chất Khử, Chất Oxi Hóa, Sự Oxi Hóa, Sự Khử – “Khử Tăng O Giảm”
Đây là những khái niệm then chốt trong phản ứng oxi hóa – khử. Hiểu rõ chúng sẽ giúp bạn dễ dàng xác định và cân bằng các phương trình phản ứng.
3.1. Chất Khử
- Định nghĩa: Chất khử là chất nhường electron.
- Số oxi hóa: Số oxi hóa của chất khử tăng sau phản ứng.
- Câu thần chú: Khử tăng (chất khử, số oxi hóa tăng).
3.2. Chất Oxi Hóa
- Định nghĩa: Chất oxi hóa là chất nhận electron.
- Số oxi hóa: Số oxi hóa của chất oxi hóa giảm sau phản ứng.
- Câu thần chú: O giảm (chất oxi hóa, số oxi hóa giảm).
3.3. Sự Oxi Hóa
- Định nghĩa: Sự oxi hóa là quá trình chất khử nhường electron, làm tăng số oxi hóa của nó.
- Liên quan: Sự oxi hóa luôn đi kèm với chất khử.
3.4. Sự Khử
- Định nghĩa: Sự khử là quá trình chất oxi hóa nhận electron, làm giảm số oxi hóa của nó.
- Liên quan: Sự khử luôn đi kèm với chất oxi hóa.
3.5. Mối Quan Hệ Tương Hỗ
Sự oxi hóa và sự khử luôn diễn ra đồng thời trong một phản ứng. Chất khử gây ra sự khử cho chất oxi hóa, và ngược lại, chất oxi hóa gây ra sự oxi hóa cho chất khử. Theo một nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội, việc nắm vững mối quan hệ này giúp học sinh, sinh viên dễ dàng tiếp cận và giải quyết các bài tập liên quan đến phản ứng oxi hóa – khử.
3.6. Bảng Tóm Tắt
| Thuật ngữ | Định nghĩa | Số oxi hóa |
|---|---|---|
| Chất khử | Chất nhường electron | Tăng |
| Chất oxi hóa | Chất nhận electron | Giảm |
| Sự oxi hóa | Quá trình chất khử nhường electron | Tăng |
| Sự khử | Quá trình chất oxi hóa nhận electron | Giảm |

4. Ví Dụ Minh Họa: Áp Dụng “Khử Tăng O Giảm”
Xét phản ứng:
Zn + CuSO4 → ZnSO4 + Cu
-
Xác định số oxi hóa:
- Zn: 0 → +2
- Cu: +2 → 0
-
Xác định chất khử và chất oxi hóa:
- Zn tăng số oxi hóa từ 0 lên +2: Zn là chất khử (khử tăng).
- Cu giảm số oxi hóa từ +2 xuống 0: CuSO4 là chất oxi hóa (o giảm).
-
Xác định sự oxi hóa và sự khử:
- Sự oxi hóa: Zn → Zn2+ + 2e (Zn bị oxi hóa).
- Sự khử: Cu2+ + 2e → Cu (Cu2+ bị khử).
5. Các Bước Lập Phương Trình Phản Ứng Oxi Hóa – Khử
Để lập phương trình phản ứng oxi hóa – khử, chúng ta sử dụng phương pháp thăng bằng electron, bao gồm các bước sau:
5.1. Bước 1: Xác Định Số Oxi Hóa
Xác định số oxi hóa của các nguyên tố có sự thay đổi số oxi hóa trong phản ứng.
5.2. Bước 2: Viết Quá Trình Oxi Hóa và Quá Trình Khử
Viết riêng quá trình oxi hóa (nhường electron) và quá trình khử (nhận electron), cân bằng số lượng nguyên tử của các nguyên tố trước và sau phản ứng.
5.3. Bước 3: Cân Bằng Số Electron
Tìm hệ số thích hợp để số electron chất khử nhường bằng số electron chất oxi hóa nhận.
5.4. Bước 4: Đặt Hệ Số vào Phương Trình Phản Ứng
Đặt các hệ số vừa tìm được vào phương trình phản ứng, sau đó cân bằng các nguyên tố còn lại theo thứ tự: kim loại, phi kim, hydro, oxy.
5.5. Bước 5: Kiểm Tra Lại
Kiểm tra lại số lượng nguyên tử của mỗi nguyên tố ở hai vế của phương trình để đảm bảo phương trình đã được cân bằng chính xác.
5.6. Ví Dụ Cụ Thể
Cân bằng phản ứng sau bằng phương pháp thăng bằng electron:
Fe + HNO3 → Fe(NO3)3 + NO + H2O
-
Xác định số oxi hóa:
- Fe: 0 → +3
- N: +5 → +2
-
Viết quá trình oxi hóa và khử:
- Fe → Fe3+ + 3e (Oxi hóa)
- N5+ + 3e → N2+ (Khử)
-
Cân bằng số electron:
- 1 x (Fe → Fe3+ + 3e)
- 1 x (N5+ + 3e → N2+)
-
Đặt hệ số vào phương trình:
- Fe + HNO3 → Fe(NO3)3 + NO + H2O
- => 1Fe + 4HNO3 → 1Fe(NO3)3 + 1NO + 2H2O
-
Kiểm tra lại: Phương trình đã cân bằng.
6. Ứng Dụng Của Phản Ứng Oxi Hóa – Khử
Phản ứng oxi hóa – khử có vai trò quan trọng trong nhiều lĩnh vực của đời sống và khoa học:
- Công nghiệp: Sản xuất kim loại, hóa chất, phân bón.
- Nông nghiệp: Sản xuất thuốc trừ sâu, phân bón.
- Y học: Sản xuất thuốc, khử trùng.
- Đời sống: Đốt nhiên liệu, pin, ắc quy.
- Môi trường: Xử lý nước thải, khí thải.
Theo TS. Nguyễn Văn A, chuyên gia hóa học tại Viện Hóa học Công nghiệp Việt Nam, việc nghiên cứu và ứng dụng hiệu quả các phản ứng oxi hóa – khử có ý nghĩa to lớn trong việc phát triển kinh tế và bảo vệ môi trường.
7. Các Loại Phản Ứng Oxi Hóa – Khử Thường Gặp
Có nhiều loại phản ứng oxi hóa – khử khác nhau, tùy thuộc vào bản chất của các chất tham gia và điều kiện phản ứng. Dưới đây là một số loại phản ứng phổ biến:
7.1. Phản Ứng Đốt Cháy
Phản ứng đốt cháy là phản ứng giữa một chất với oxy, thường tỏa nhiệt và ánh sáng. Ví dụ:
- Đốt cháy than: C + O2 → CO2
- Đốt cháy khí metan: CH4 + 2O2 → CO2 + 2H2O
7.2. Phản Ứng Điều Chế Kim Loại
Nhiều kim loại được điều chế bằng cách khử các oxit kim loại bằng các chất khử như C, CO, H2, hoặc các kim loại mạnh hơn. Ví dụ:
- Điều chế sắt từ oxit sắt: Fe2O3 + 3CO → 2Fe + 3CO2
- Điều chế đồng từ oxit đồng: CuO + H2 → Cu + H2O
7.3. Phản Ứng Ăn Mòn Kim Loại
Ăn mòn kim loại là quá trình kim loại bị oxi hóa bởi môi trường, dẫn đến sự phá hủy kim loại. Ví dụ:
- Sắt bị gỉ: 4Fe + 3O2 + 6H2O → 4Fe(OH)3
7.4. Phản Ứng Trong Pin và Ắc Quy
Pin và ắc quy hoạt động dựa trên các phản ứng oxi hóa – khử để tạo ra dòng điện. Ví dụ:
- Pin điện hóa: Zn + Cu2+ → Zn2+ + Cu
- Ắc quy chì: Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
7.5. Phản Ứng Trong Hô Hấp và Quang Hợp
Các quá trình sinh học quan trọng như hô hấp và quang hợp cũng là các phản ứng oxi hóa – khử.
- Hô hấp: C6H12O6 + 6O2 → 6CO2 + 6H2O
- Quang hợp: 6CO2 + 6H2O → C6H12O6 + 6O2
8. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Oxi Hóa – Khử
Tốc độ của phản ứng oxi hóa – khử có thể bị ảnh hưởng bởi nhiều yếu tố:
8.1. Nồng Độ
Nồng độ của các chất phản ứng càng cao, tốc độ phản ứng càng lớn. Điều này là do khi nồng độ tăng, số lượng va chạm hiệu quả giữa các phân tử tăng lên.
8.2. Nhiệt Độ
Nhiệt độ tăng thường làm tăng tốc độ phản ứng. Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn và có nhiều năng lượng hơn, dẫn đến số lượng va chạm hiệu quả tăng lên.
8.3. Chất Xúc Tác
Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong phản ứng. Chất xúc tác tạo ra một con đường phản ứng khác với năng lượng hoạt hóa thấp hơn.
8.4. Bề Mặt Tiếp Xúc
Đối với các phản ứng có chất rắn tham gia, diện tích bề mặt tiếp xúc giữa các chất phản ứng càng lớn, tốc độ phản ứng càng cao.
8.5. Áp Suất
Đối với các phản ứng có chất khí tham gia, áp suất tăng thường làm tăng tốc độ phản ứng.
9. Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng “Khử Tăng O Giảm”
Dưới đây là một số câu hỏi thường gặp về phản ứng oxi hóa – khử, giúp bạn củng cố kiến thức:
-
Câu hỏi: “Khử tăng o giảm” nghĩa là gì?
Trả lời: “Khử tăng o giảm” là câu thần chú giúp nhớ quy tắc: chất khử thì số oxi hóa tăng, chất oxi hóa thì số oxi hóa giảm.
-
Câu hỏi: Chất khử là gì?
Trả lời: Chất khử là chất nhường electron trong phản ứng oxi hóa – khử.
-
Câu hỏi: Chất oxi hóa là gì?
Trả lời: Chất oxi hóa là chất nhận electron trong phản ứng oxi hóa – khử.
-
Câu hỏi: Sự oxi hóa là gì?
Trả lời: Sự oxi hóa là quá trình chất khử nhường electron.
-
Câu hỏi: Sự khử là gì?
Trả lời: Sự khử là quá trình chất oxi hóa nhận electron.
-
Câu hỏi: Làm thế nào để xác định số oxi hóa của một nguyên tố trong hợp chất?
Trả lời: Tuân theo các quy tắc xác định số oxi hóa đã nêu ở phần 2.
-
Câu hỏi: Phương pháp thăng bằng electron dùng để làm gì?
Trả lời: Dùng để cân bằng các phương trình phản ứng oxi hóa – khử.
-
Câu hỏi: Phản ứng oxi hóa – khử có ứng dụng gì trong đời sống?
Trả lời: Rất nhiều, từ sản xuất công nghiệp, nông nghiệp, y học đến các hoạt động hàng ngày như đốt nhiên liệu, pin, ắc quy.
-
Câu hỏi: Tại sao cần phải cân bằng phương trình phản ứng oxi hóa – khử?
Trả lời: Để đảm bảo tuân thủ định luật bảo toàn khối lượng, số lượng nguyên tử của mỗi nguyên tố phải bằng nhau ở hai vế của phương trình.
-
Câu hỏi: Các yếu tố nào ảnh hưởng đến tốc độ phản ứng oxi hóa – khử?
Trả lời: Nồng độ, nhiệt độ, chất xúc tác, bề mặt tiếp xúc và áp suất.
10. Tổng Kết
Hiểu rõ về phản ứng oxi hóa – khử và quy tắc “khử tăng o giảm” là nền tảng quan trọng để học tốt môn Hóa học. Hy vọng bài viết này của CAUHOI2025.EDU.VN đã cung cấp cho bạn những kiến thức hữu ích và dễ hiểu.
Bạn đang gặp khó khăn trong việc giải bài tập hóa học? Bạn muốn tìm hiểu sâu hơn về các phản ứng hóa học phức tạp? Hãy truy cập ngay CAUHOI2025.EDU.VN để khám phá kho tài liệu phong phú và đặt câu hỏi cho các chuyên gia của chúng tôi. Chúng tôi luôn sẵn sàng hỗ trợ bạn trên con đường chinh phục tri thức!
Thông tin liên hệ:
- Địa chỉ: 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam
- Số điện thoại: +84 2435162967
- Trang web: CauHoi2025.EDU.VN
Từ khóa liên quan: Phản ứng oxi hóa khử, chất khử, chất oxi hóa, số oxi hóa, cân bằng phản ứng oxi hóa khử, hóa học.

