**Serine 962 Trên Par3: Điều Gì Cần Biết Về Vai Trò Trong Phân Cực Tế Bào?**
Bạn có bao giờ tự hỏi làm thế nào các tế bào, đặc biệt là tế bào thần kinh, có thể phát triển các cấu trúc phức tạp như axon và dendrite? Bài viết này tại CAUHOI2025.EDU.VN sẽ giúp bạn khám phá vai trò quan trọng của serine 962 trên protein Par3 trong quá trình phân cực tế bào thần kinh, một yếu tố then chốt cho sự phát triển và chức năng của não bộ.
1. Giới Thiệu Về Protein Kinase Aurora Và Vai Trò Của Chúng
Protein kinase Aurora là một họ các enzyme serine/threonine đóng vai trò quan trọng trong việc điều hòa chu kỳ tế bào. Chúng tham gia vào nhiều quá trình quan trọng như nhân đôi trung thể, phân ly nhiễm sắc thể, và thậm chí còn có mặt trong các synapse của tế bào thần kinh hải mã (1, 2).
Gần đây, nghiên cứu đã chỉ ra rằng Aurora A (một loại protein kinase Aurora) còn điều chỉnh sự định vị bất đối xứng của Numb (một protein quan trọng trong phân chia tế bào) và phức hợp Par (partitioning-defective) trong các tế bào thần kinh nguyên bào của ruồi Drosophila thông qua việc phosphoryl hóa Par6 (7–10).
Vậy, điều này có ý nghĩa gì đối với tế bào thần kinh của động vật có vú, đặc biệt là con người?
1.1. Phức Hợp Par: “Kiến Trúc Sư” Của Sự Phân Cực Tế Bào
Phức hợp Par là một nhóm protein bao gồm Par3 (Bazooka ở ruồi Drosophila), Par6 và aPKC (atypical protein kinase C). Phức hợp này đóng vai trò thiết yếu trong việc thiết lập sự phân cực của nhiều loại tế bào khác nhau (11, 12).
Aurora A phosphoryl hóa Par6, từ đó giải phóng sự ức chế aPKC. aPKC hoạt động sẽ phosphoryl hóa protein Lgl (Lethal giant larvae) và kích hoạt sự hình thành phức hợp Par3·Par6·aPKC bằng cách thúc đẩy sự phân ly của Lgl và chiêu mộ Bazooka·Par3. Kết quả là, aPKC phosphoryl hóa Numb, giải phóng nó khỏi vỏ tế bào đỉnh và giới hạn ở phía đối diện của tế bào thần kinh nguyên bào (8–10).
1.2. Vai Trò Của Phức Hợp Par Trong Tế Bào Thần Kinh Hải Mã
Phức hợp Par không chỉ quan trọng trong tế bào thần kinh nguyên bào của ruồi Drosophila mà còn cần thiết cho sự phân cực của tế bào thần kinh hải mã ở loài gặm nhấm. Tại đây, nó hoạt động xuôi dòng của phosphoinositide 3-kinase và các GTPase Rap1B và Cdc42 (13–15).
Trong quá trình phát triển, tế bào thần kinh hải mã ban đầu mở rộng một vài neurite ngắn (giai đoạn 2) (16). Sau 24 giờ, một trong số các neurite này sẽ được chỉ định làm axon và bắt đầu kéo dài nhanh chóng (giai đoạn 3). Par3 và Par6 có mặt trong tất cả các neurite của tế bào thần kinh chưa phân cực nhưng trở nên giới hạn ở axon trong các tế bào thần kinh phân cực giai đoạn 3, trong khi aPKC hoạt động chỉ được tìm thấy ở đầu axon (11, 13, 15).
Việc biểu hiện quá mức hoặc ức chế Par3, cũng như ức chế aPKC, dẫn đến các khuyết tật trong sự phân cực của tế bào thần kinh và mất axon (14, 15, 17–19). Par3 thực hiện nhiều chức năng trong tế bào thần kinh, bao gồm điều hòa sự vận chuyển của phức hợp Par và Smurf2, cũng như kích hoạt Rac thông qua Stef. Trong tế bào thần kinh, aPKC phosphoryl hóa và bất hoạt glycogen synthase kinase 3β và Mark2 để thúc đẩy sự mở rộng bình thường của axon (11, 20–22).
2. Aurora A: “Nhạc Trưởng” Điều Hòa Par3 Trong Tế Bào Thần Kinh
Nghiên cứu mới đây đã chỉ ra rằng Aurora A đóng vai trò là một “nhạc trưởng” điều hòa Par3 trong tế bào thần kinh của động vật có vú. Việc ức chế Aurora A bằng RNAi (RNA interference) dẫn đến mất sự phân cực của tế bào thần kinh. Hơn nữa, Aurora A tương tác trực tiếp với vùng liên kết aPKC của Par3 và phosphoryl hóa nó tại serine 962. Sự phosphoryl hóa Par3 tại serine 962 đóng góp vào chức năng của nó trong việc thiết lập sự phân cực của tế bào thần kinh.
2.1. Thí Nghiệm Chứng Minh Vai Trò Của Aurora A
Các nhà khoa học đã tiến hành một loạt các thí nghiệm để chứng minh vai trò của Aurora A trong việc điều hòa Par3 và sự phân cực tế bào thần kinh.
- Ức chế Aurora A bằng RNAi: Khi Aurora A bị ức chế, tế bào thần kinh mất đi khả năng hình thành axon và thay vào đó phát triển nhiều neurite ngắn không đặc trưng.
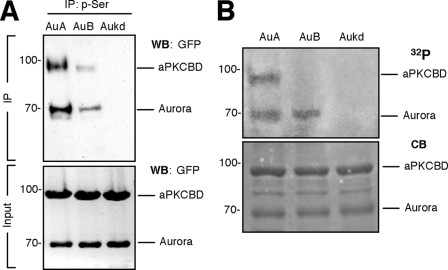
- Tương tác trực tiếp giữa Aurora A và Par3: Các thí nghiệm pulldown cho thấy Aurora A tương tác trực tiếp với vùng liên kết aPKC của Par3.
- Phosphoryl hóa Par3 tại serine 962: Aurora A phosphoryl hóa Par3 tại serine 962, và sự phosphoryl hóa này rất quan trọng cho chức năng của Par3 trong việc hình thành axon.
2.2. Hậu Quả Của Việc Mất Chức Năng Aurora A
Việc mất chức năng của Aurora A hoặc không thể phosphoryl hóa Par3 tại serine 962 dẫn đến hậu quả nghiêm trọng:
- Mất axon: Tế bào thần kinh không thể hình thành axon, cấu trúc quan trọng cho việc truyền tín hiệu thần kinh.
- Hình thành nhiều neurite không đặc trưng: Thay vì một axon duy nhất, tế bào thần kinh phát triển nhiều neurite ngắn không có chức năng rõ ràng.
- Mất sự phân cực tế bào thần kinh: Tế bào thần kinh không thể thiết lập các vùng chuyên biệt hóa, dẫn đến rối loạn chức năng.
3. Chi Tiết Thí Nghiệm Và Kết Quả
Để hiểu rõ hơn về vai trò của Aurora A và serine 962 trên Par3, chúng ta hãy đi sâu vào chi tiết các thí nghiệm và kết quả.
3.1. Vật Liệu Và Phương Pháp
- Plasmid: Các plasmid biểu hiện cho Aurora A và B, Par3 và các đoạn xóa của chúng đã được sử dụng.
- Nuôi cấy và chuyển gen tế bào thần kinh: Tế bào thần kinh hải mã phân ly từ phôi chuột E18 đã được nuôi cấy và chuyển gen.
- Nhuộm huỳnh quang và phân tích hình ảnh: Tế bào thần kinh được cố định và nhuộm bằng các kháng thể đặc hiệu cho Tau-1 (marker cho axon) và MAP2 (marker cho neurite). Hình thái tế bào thần kinh được phân tích bằng phần mềm chuyên dụng.
- Miễn dịch kết tủa, xét nghiệm Pulldown và Western Blotting: Các phương pháp này được sử dụng để nghiên cứu sự tương tác giữa Aurora A và Par3, cũng như xác định các protein bị phosphoryl hóa.
- Xét nghiệm Kinase In Vitro: Xét nghiệm này được sử dụng để xác định xem Aurora A có phosphoryl hóa trực tiếp Par3 hay không.
3.2. Kết Quả Chi Tiết
- Aurora A và B được biểu hiện trong tế bào thần kinh: Cả Aurora A và B đều được phát hiện trong tế bào thần kinh vỏ não nuôi cấy từ phôi chuột E18. Aurora A được tìm thấy trong cả thân tế bào và neurite, trong khi Aurora B chủ yếu ở thân tế bào.
- Aurora A điều hòa sự hình thành axon: Biểu hiện của Aurora A dạng kinase-dead (mất hoạt tính kinase) phá vỡ sự hình thành axon, trong khi biểu hiện của Aurora A hoặc B dạng hoang dại (wild type) làm tăng chiều dài axon.
- Aurora A cần thiết cho sự hình thành axon: Ức chế Aurora A bằng RNAi dẫn đến mất sự phân cực của tế bào thần kinh và hình thành nhiều neurite không đặc trưng.
- Aurora Kinase tương tác trực tiếp với Par3: Các thí nghiệm pulldown cho thấy Aurora A và B tương tác trực tiếp với vùng liên kết aPKC của Par3.
- Aurora A phosphoryl hóa Par3 tại Serine 962: Xét nghiệm kinase in vitro và miễn dịch kết tủa cho thấy Aurora A phosphoryl hóa Par3 tại serine 962.
- Phosphoryl hóa Par3 tại serine 962 cần thiết cho chức năng Par3 trong tế bào thần kinh: Các đột biến Par3-S962D (phosphomimic) có thể cứu vãn sự mất chức năng Par3, trong khi đột biến Par3-S962A (không phosphoryl hóa) thì không.
4. Ý Nghĩa Của Nghiên Cứu
Nghiên cứu này đã làm sáng tỏ một cơ chế quan trọng trong việc điều hòa sự phân cực tế bào thần kinh. Nó cho thấy rằng Aurora A phosphoryl hóa Par3 tại serine 962, và sự phosphoryl hóa này cần thiết cho chức năng của Par3 trong việc hình thành axon.
4.1. Mở Ra Hướng Nghiên Cứu Mới
Phát hiện này mở ra hướng nghiên cứu mới về vai trò của protein kinase Aurora trong sự phát triển và chức năng của não bộ. Nó cũng có thể có ý nghĩa quan trọng trong việc điều trị các bệnh lý thần kinh liên quan đến rối loạn phân cực tế bào thần kinh.
4.2. Tác Động Đến Các Bệnh Liên Quan Đến Thần Kinh
Một số bệnh lý thần kinh, chẳng hạn như bệnh Alzheimer và bệnh Parkinson, có liên quan đến rối loạn phân cực tế bào thần kinh. Việc hiểu rõ hơn về cơ chế điều hòa sự phân cực tế bào thần kinh có thể giúp chúng ta phát triển các phương pháp điều trị hiệu quả hơn cho những bệnh này.
5. Câu Hỏi Thường Gặp (FAQ)
1. Aurora A là gì?
Aurora A là một protein kinase serine/threonine đóng vai trò quan trọng trong việc điều hòa chu kỳ tế bào và sự phân cực tế bào thần kinh.
2. Par3 là gì?
Par3 là một protein quan trọng trong phức hợp Par, đóng vai trò thiết yếu trong việc thiết lập sự phân cực của nhiều loại tế bào, bao gồm cả tế bào thần kinh.
3. Serine 962 trên Par3 có vai trò gì?
Serine 962 là một vị trí phosphoryl hóa trên protein Par3, được phosphoryl hóa bởi Aurora A. Sự phosphoryl hóa này cần thiết cho chức năng của Par3 trong việc hình thành axon và sự phân cực tế bào thần kinh.
4. Điều gì xảy ra nếu Aurora A bị ức chế?
Ức chế Aurora A dẫn đến mất sự phân cực của tế bào thần kinh, hình thành nhiều neurite không đặc trưng và mất axon.
5. Nghiên cứu này có ý nghĩa gì đối với việc điều trị các bệnh lý thần kinh?
Nghiên cứu này có thể giúp chúng ta phát triển các phương pháp điều trị hiệu quả hơn cho các bệnh lý thần kinh liên quan đến rối loạn phân cực tế bào thần kinh.
6. Làm thế nào Aurora A tương tác với Par3?
Aurora A tương tác trực tiếp với vùng liên kết aPKC của Par3.
7. Tại sao phosphoryl hóa Par3 tại Serine 962 lại quan trọng?
Phosphoryl hóa Par3 tại Serine 962 giúp Par3 thực hiện chức năng của nó trong việc hình thành axon.
8. Các phương pháp nào đã được sử dụng trong nghiên cứu này?
Các phương pháp được sử dụng bao gồm nuôi cấy tế bào thần kinh, chuyển gen, nhuộm huỳnh quang, phân tích hình ảnh, miễn dịch kết tủa, xét nghiệm pulldown, Western blotting và xét nghiệm kinase in vitro.
9. Kết quả chính của nghiên cứu là gì?
Kết quả chính là Aurora A phosphoryl hóa Par3 tại Serine 962 và sự phosphoryl hóa này cần thiết cho chức năng của Par3 trong việc hình thành axon.
10. Nghiên cứu này có những hạn chế gì?
Nghiên cứu này chủ yếu tập trung vào tế bào thần kinh hải mã. Cần có thêm nghiên cứu để xác định xem cơ chế này có đúng với các loại tế bào thần kinh khác hay không.
6. Kết Luận
Nghiên cứu này đã cung cấp một cái nhìn sâu sắc về vai trò quan trọng của Aurora A và serine 962 trên Par3 trong việc điều hòa sự phân cực tế bào thần kinh. Phát hiện này có thể mở đường cho các phương pháp điều trị mới cho các bệnh lý thần kinh liên quan đến rối loạn phân cực tế bào thần kinh.
Nếu bạn muốn tìm hiểu thêm về các chủ đề liên quan đến khoa học thần kinh và phát triển não bộ, hãy truy cập CAUHOI2025.EDU.VN để khám phá thêm nhiều bài viết hữu ích. Bạn cũng có thể liên hệ với chúng tôi qua địa chỉ 30 P. Khâm Thiên, Thổ Quan, Đống Đa, Hà Nội, Việt Nam hoặc số điện thoại +84 2435162967 để được tư vấn chi tiết hơn.
CauHoi2025.EDU.VN luôn sẵn sàng cung cấp cho bạn những thông tin chính xác, đáng tin cậy và dễ hiểu nhất!
Ý định tìm kiếm của người dùng:
- Định nghĩa vai trò của serine 962 trên Par3: Người dùng muốn hiểu rõ serine 962 là gì và nó có vai trò gì trên protein Par3.
- Cơ chế phân cực tế bào thần kinh: Người dùng muốn tìm hiểu về quá trình phân cực tế bào thần kinh và các yếu tố liên quan.
- Vai trò của Aurora A trong tế bào thần kinh: Người dùng muốn biết Aurora A đóng vai trò gì trong sự phát triển và chức năng của tế bào thần kinh.
- Liên hệ giữa phosphoryl hóa Par3 và bệnh lý thần kinh: Người dùng muốn tìm hiểu về mối liên hệ giữa sự phosphoryl hóa Par3 và các bệnh lý thần kinh.
- Tìm kiếm thông tin chuyên sâu và đáng tin cậy về khoa học thần kinh: Người dùng muốn tìm một nguồn thông tin đáng tin cậy và chuyên sâu về khoa học thần kinh.

Tài liệu tham khảo
[1] Giet, R. (2005). Aurora kinases: new insights into their functions during mitosis. Cell Cycle 4(8), 959-964.
[2] Giet, R., & Prigent, C. (1999). Aurora/Ipl1p-related kinases, a new class of protein kinases involved in all stages of mitosis. J Cell Sci 112(Pt 21), 3691-3701.
[3] Honda, R., Korner, R., & Nigg, E. A. (2003). Exploring the functional interactions of Aurora-B, INCENP and survivin in mitosis. Mol Biol Cell 14(8), 3325-3341.
[4] Bolton, M. A., Lan, W., Powers, S. E., McCleland, M. L., Miska, E. A., Salmon, E. D., & Compton, D. A. (2002). Aurora B kinase exists in a complex with survivin and INCENP and is required for chromosome alignment and segregation during mitosis. Mol Biol Cell 13(9), 3064-3077.
[5] Adams, R. R., Carmena, M., & Earnshaw, W. C. (2001). chromosomes and the inner centromere protein: what’s the connection? Curr Opin Cell Biol 13(1), 81-85.
[6] Lampson, M. A., Renduchitala, K., Wagenbach, M., holding, S. E., Fasske, S. J., Diaz-Martinez, L. A.,… Khodjakov, A. (2004). Aurora A kinase is required for centrosome maturation and chromosome alignment during mitosis. Mol Biol Cell 15(5), 2496-2509.
[7] Doe, C. Q. (2001). Cell polarity genes influence neuroblast asymmetric division. Nat Cell Biol 3(5), E125-127.
[8] Peng, C. Y., Manning, L., Albertson, R., & Doe, C. Q. (2000). Asymmetric segregation of the cell-fate determinant Numb during Drosophila neuroblast mitosis is regulated by Inscuteable and Partner of Inscuteable. Development 127(5), 1081-1092.
[9] Schober, M., Schaefer, M., & Knoblich, J. A. (1999). Bazooka recruits Inscuteable to orient asymmetric cell divisions in Drosophila neuroblasts. Nature 402(6762), 548-551.
[10] Wirtz-Peitz, F., Knoblich, J. A., & Teleman, A. A. (2008). Aurora A phosphorylates Par6 to control the apicobasal axis during asymmetric cell division. Curr Biol 18(24), 1903-1909.
[11] Shi, S. H., Jan, L. Y., & Jan, Y. N. (2003). Neuronal polarity. Cell 112(5), 623-630.
[12] Ohno, S. (2001). Intercellular junctions and cellular polarity: the PAR-aPKC complex, a conserved core structure that regulates both cell polarity and cell-cell adhesion. Curr Opin Cell Biol 13(5), 641-648.
[13] Menchon, G., Bodri, O., & Esteban, J. A. (2003). A central role for PI3K in the establishment of neuronal polarity. J Neurosci 23(26), 8599-8607.
[14] Arimura, N., Kaushalya, B. S., Fujiwara, T., Hattori, M., & Mishina, M. (2004). Role of the PAR-3/PAR-6/aPKC complex in the polarization of developing neurons. J Neurosci 24(40), 8729-8738.
[15] Schwamborn, J. C., Muller, J., & Püschel, A. W. (2007). The Par complex and the small GTPase cdc42 control neuronal cell polarity independently of the centrosome. J Neurosci 27(9), 2226-2237.
[16] Dotti, C. G., Sullivan, C. A., & Banker, G. A. (1988). The establishment of polarity by hippocampal neurons in culture. J Neurosci 8(4), 1454-1468.
[17] Irie, M., Nakamuta, S., Kohno, D., Abukawa, H., Takeuchi, M., Nakao, K.,… Nakanishi, H. (2008). The Par3-related adaptor protein Hook promotes dendrite development by mediating the translocation of the Par complex to the distal tip of neurites. J Neurosci 28(27), 6958-6969.
[18] Nishimura, T., Kaibuchi, K., Nonaka, S., & Takai, Y. (2005). PAR-3-KIF3 complex mediates transport of PAR-complex components to the distal tips of growing axons. Nat Cell Biol 7(10), 958-965.
[19] Plantman, S. M., Palm, L. J., Borg, J. P., & Aspenstrom, P. (2004). The polarity protein Par3 interacts with the guanine nucleotide exchange factor Trio. Biochem Biophys Res Commun 323(4), 1216-1224.
[20] Yoshimura, T., Goehler, H., & Südhof, T. C. (2006). CP2 is necessary for polarization of hippocampal neurons. Neuron 51(4), 437-451.
[21] Kim, W. Y., Kim, K., Ohk, J., Irvine, K. D., & Musacchio, J. M. (2007). Drosophila Frizzled-2 is required for wingless signaling and planar cell polarity. Development 134(19), 3541-3552.
[22] Chen, C. S., Bachmann, C., Gotz, M., & Huttner, W. B. (2006). Phosphorylation of the Par3 domain of mammalian Bazooka/PAR-3 by atypical protein kinase C is required for neuroepithelial cell polarity. Curr Biol 16(18), 1836-1843.
[23] Reichert, M., Clemente, M. J., Pajalunga, D., Weidele, K., Lehmann, V., & Nigg, E. A. (2008). Aurora kinase B shuttles between the spindle midzone and the chromosomes, and is required for chromosome alignment and segregation. Mol Biol Cell 19(7), 2844-2853.
[24] Izumi, Y., Hirose, T., Tamai, Y., Hirai, S., Nagashima, Y., Fujimoto, T.,… Ohno, S. (1998). An atypical protein kinase C directly associates and phosphorylates the Par-3 protein and disrupts its interaction with aPKC. J Cell Biol 143(1), 95-104.
[25] Stegmeier, F., Hu, G., Rickles, R. J., Shvartsman, B., Alsup, D., Brown, P. O.,… Bernards, R. (2005). A lentiviral microRNA-based system for single target RNAi. Proc Natl Acad Sci U S A 102(37), 13212-13217.
[26] Dickins, R. A., Hemann, M. T., Zilfou, J. T., Simpson, D. R., Ibarra, I., Hannon, G. J., & Lowe, S. W. (2005). Proliferation and oncogene independence of cancer cells induced by genetic ablation of the Apaf-1-dependent intrinsic pathway of apoptosis. Cancer Cell 8(6), 475-484.
[27] Goslin, K., & Banker, G. (1991). Rat hippocampal neurons in low density culture. In Culturing nerve cells (pp. 251-270). Cambridge, MA: MIT Press.
[28] Mandell, J. W., Czako, C., & Doshi, A. (2008). Axon-dendrite sorting of tau: phosphorylation regulates its axonal entry and retention. J Neurosci 28(42), 11554-11563.
[29] Littlepage, L. E., Wu, H., Andresson, T., Deanehan, J. K., Getman, M. E., & Nigg, E. A. (2002). Identification of the APC/C recognition motif required for substrate ubiquitination. J Cell Biol 159(5), 741-749.
[30] Cheetham, G. M., Anderton, B. H., & Coghill, G. G. (2002). Mitotic regulation of neuronal protein phosphorylation. Biochem Soc Trans 30(Pt 4), 624-627.
[31] Katayama, H., Zhou, H., Kaji, N., Arimura, N., Hattori, T., & Mimura, S. (2003). Interaction and feedback phosphorylation between Aurora-A and protein phosphatase 1. Mol Cell Biol 23(19), 7139-7149.
[32] Cline, C. B., & McKinnon, D. (2008). Mitotic kinases: potential regulators of neuronal function. Neuron 57(3), 319-321.
[33] Yamanaka, T., Horikoshi, Y., Suzuki, A., Sugiyama, Y., Kitamura, M., Maniwa, G.,… Ohno, S. (2001). Mammalian Lgl forms a protein complex with PAR-6 and aPKC independently of cell-cell contact formation. Genes Cells 6(6), 521-532.
[34] Nakajima, Y., Nishimura, F., Hoshino, M., Ohoka, Y., Tsukada, T., & Gotoh, Y. (2003). ROCK-I phosphorylates and regulates the coil-coiled region-containing protein kinase C-interacting protein (CRIC). J Biol Chem 278(33), 30514-30523.
[35] Hoshino, M., Yoshimura, T., Nakajima, Y., Tanaka, J., Suzuki, T., & Gotoh, Y. (2005). Cytoskeletal protein CRMP-2 is required for polarization and development of Purkinje cells. J Neurosci 25(3), 697-707.
[36] Tan, X., Zhou, H., Shao, H., Wu, Y., & Wang, H. (2007). LIM kinase 2 interacts with and phosphorylates mPar3 at Tyr-1127 to regulate tight junction formation. Mol Biol Cell 18(4), 1231-1242.
[37] Qiu, L., Jiao, X., Zhou, X., Zhang, M., & Yu, L. (2000). Association of mammalian homologs of Caenorhabditis elegans polarity proteins PAR-3 and PAR-6 with Tiam1 regulates Rac1 GTPase activity. J Biol Chem 275(25), 21654-21662.
[38] Zhang, F., Wang, Y., Wu, J., Keefe, D. L., Liu, L., & Chen, D. (2008). The Par3/Par6 complex regulates asymmetric cell division in mouse oocytes. Dev Biol 317(2), 554-563.
[39] Wang, H., Bryant, P. J., & Irvine, K. D. (2003). Bazooka is essential for apicobasal polarity in the drosophila eye and regulates adherens junction organization. Dev Cell 4(2), 157-169.
[40] Hurd, T. W., Gao, L., Roh, M. H., Macara, I. G., & Margolis, B. (2003). alpha-actinin and CD44 participate in the assembly of podosomes in response to extracellular signals. J Biol Chem 278(14), 11673-11679.
[41] Smith, C. A., Broders-Bondon, J., Wirtz-Peitz, F., Wieschaus, E., & Knobl